亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及生成气体产物的成分。已知:
①NO+NO2+2OH-=2NO2-+2H2O
②气体液化的温度:NO2 21℃、NO -152℃
(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(从左向右连接):A→C→_______→_______→_______;组装好仪器后,接下来进行的操作是________________。
(2)关闭弹簧夹,打开分液漏斗活塞,滴入70%的硫酸后, A中产生红棕色气体.
①确认A中产生气体含有NO,依据的现象是_____________________________.
②装置E的作用是_______________________________________________________
(3)如果向D中通入过量O2,则装置B中发生反应的化学方程式为________________.
如果没有装置C,对实验结论造成的影响是______________________________。
(4)通过上述实验探究过程,可得出装置A中反应的化学方程式是_______________。
(5)工业生产中氮氧化物的排放会造成环境污染,可采用如下方法处理氮氧化物:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
则CH4将NO2还原为NO的热化学方程式为:___________________________.
如何防止铁的锈蚀是工业上研究的重点内容。为研究铁锈蚀的影响因素,某同学做了如下探究实验:
| 序号 |
内容 |
实验现象 |
| 1 |
常温下将铁丝放在干燥空气中一个月 |
干燥的铁丝表面依然光亮 |
| 2 |
常温下将铁丝放在潮湿空气中一小时 |
铁丝表面依然光亮 |
| 3 |
常温下将铁丝放在潮湿的空气中一个月 |
铁丝表面已变得灰暗 |
| 4 |
将潮湿的铁丝放在常温的氧气流中一小时 |
铁丝表面略显灰暗 |
| 5 |
将潮湿的铁丝放在高于常温的氧气流中一小时 |
铁丝表面已变得灰暗 |
| 6 |
将浸过氯化钠溶液的铁丝放在高于常温的氧气流中一小时 |
铁丝表面灰暗程度比实验5严重 |
回答以下问题:
(1)上述实验中发生了电化学腐蚀的是(填实验序号)__________;在电化学腐蚀中,负极反应是__________;正极反应是__________。
(2)由该实验可知,可以影响铁锈蚀速率的因素是____________________。
(3)为防止铁的锈蚀,工业上普遍采用的方法是__________(答出两种方法)。
(1)如图所示,夹子开始时处于关闭状态,将滴管中液体A滴入试管②中,与气体B充分反应,打开夹子,可观察到试管①中96 ℃的水立即沸腾;则液体A和气体B的组合可能的是__________(填标号)。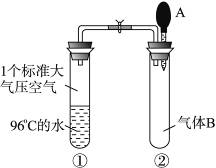
A.氢氧化钠溶液;NO2气体
B.饱和食盐水;氯气
C.碳酸氢钠溶液;二氧化硫气体
D.氯化钙溶液;二氧化碳气体
(2)下列有关实验的叙述,不正确的是__________(填标号)。
A.金属钠保存在煤油中,硝酸保存在棕色细口瓶中,且用磨口玻璃塞密封瓶口
B.用渗析法分离淀粉、KNO3
C.用氨水洗涤做过银镜反应的试管
D.用标准浓度的NaOH溶液测定未知浓度的盐酸,中和滴定前观察滴定管的液面高度为俯观,滴定终点时观察液面高度为仰视,测出的盐酸的浓度偏高
请用下图的装置设计一个实验,以测定SO2转化为SO3的转化率。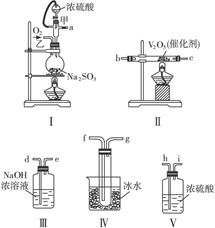
(1)这些装置的连接顺序(按气体从左到右的方向)是______________。(填各接口的编号)
(2)实验时甲仪器的作用与原理是______________。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是______________。
(4)Ⅳ处观察到的现象是______________。
(5)在Ⅰ处用大火加热烧瓶时SO2的转化率会______________。(填“填大”“不变”或“减小”)
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重 m g,则本实验中SO2的转化率为______________。
(14分)化学上常用燃烧法确定有机物组成,这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成,图中所列装置是用燃烧法确定有机物分子式常用的装置。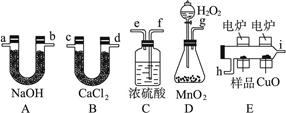
完成下列问题:
(1)产生的氧气按从左到右流向,所选择的装置各导管的连接顺序是________________。
(2)C装置中浓硫酸的作用是__________________。
(3)D装置中MnO2的作用是__________________。
(4)燃烧管中CuO的作用是__________________。
(5)若准确称取0.09 g样品(只含C、H、O三种元素中的两种或三种)经充分燃烧后,A管质量增加13.2 g,B管质量增加0.54 g,则该有机物的实验式为__________________________。
(6)要确定该有机物的分子式,还要_______________。
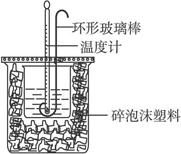
实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据:
| 实验次数 |
起始温度t1/℃ |
终止温度t2/℃ |
|
| 盐酸 |
NaOH溶液 |
||
| 1 |
20.2 |
20.3 |
23.7 |
| 2 |
20.3 |
20.5 |
23.8 |
| 3 |
21.5 |
21.6 |
24.9 |
试完成下列问题:
(1)实验时用环形玻璃棒搅拌溶液的方法是_____________________________________,
不能用铜丝搅拌棒代替环形玻璃棒的理由是__________________________________。
(2)经数据处理,t2-t1="3.4" ℃。则该实验测得的中和热ΔH=_________〔盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算〕。
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为ΔH1,则ΔH1与ΔH的关系为:ΔH1_________ΔH(填“<”“>”或“=”=,理由是________________________。