Ⅰ.电离平衡常数(用K表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
| 化学式 |
HF |
H2CO3 |
HClO |
| 电离平衡常数 (K) |
7.2×10-4 |
K1=4.4×10-7 K2=4.7×10-11 |
3.0×10-8 |
(1)物质的量浓度均为0.1mol/L的下列四种溶液:①Na2CO3溶液 ②NaHCO3溶液 ③NaF溶液 ④NaClO溶液。依据数据判断pH由大到小的顺序是______________。
(2)25℃时,在20mL0.1mol·L—1氢氟酸中加入VmL0.1mol·L—1NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是_______。
A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(F-)<c(Na+)=0.1mol·L—1
(3)已知25℃时,①HF(aq)+OH-(aq)=F-(aq)+H2O(l) ΔH=-akJ·mol—1,
②H+(aq)+OH-(aq)=H2O(l) ΔH=-bkJ·mol—1,
氢氟酸的电离方程式及热效应可表示为________________________。
(4)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H—O—F。HFO与等物质的量的H2O反应得到HF和化合物A,则每生成1molHF转移_______mol电子。
Ⅱ.氯化硫酰(SO2Cl2)主要用作氯化剂。它是一种无色液体,熔点–54.1℃,沸点69.1℃。氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:
SO2(g)+Cl2(g)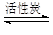 SO2Cl2(l) △H=–97.3kJ·mol—1
SO2Cl2(l) △H=–97.3kJ·mol—1
(1)试写出常温常压下化学平衡常数K的表达式:K=_________________;
(2)对上述反应,若要使化学平衡常数K增大,化学反应速率v正也增大,可采取的措施是_____(选填编号)。
a.降低温度 b.移走SO2Cl2
c.增加反应物浓度 d.无法满足上述条件
(3)下列描述中能说明上述反应已达平衡的是____________(选填编号)。
a.υ(Cl 2)=υ(SO2) b.容器中气体压强不随时间而变化
c.c(Cl 2) : c(SO2)=1:1 d.容器中气体颜色不随时间两变化
(4)300℃时,体积为1L的密闭容器中充入16.20g SO2Cl2,达到平衡时容器中含SO2 7.616g。若在上述中的平衡体系中,再加入16.20g SO2Cl2,当再次达平衡时,容器中含SO2的质量范围是________________________。
硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。
(1)将烧碱吸收H2S后的溶液加入到如图—1所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:S2-—2e- S(n—1)S+ S2-
S(n—1)S+ S2- Sn2-
Sn2-
①写出电解时阴极的电极反应式:
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成
(2)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图—2所示。
①在图示的转化中,化合价不变的元素是
②反应中当有1molH2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需要消耗O2的物质的量为
③在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有
(3)H2S在高温下分解生成硫蒸气和H2。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图—3所示,H2S在高温下分解反应的化学方程式为
硫酸锌是制备荧光粉的原料之一。工业上由锌白矿(主要成分是ZnO,还含有Fe2O3、CuO、SiO2等杂质)制备ZnSO4•7H2O的流程如下。
已知:常温下,溶液中的Fe3+、Zn2+、Fe2+以氢氧化物形式完全沉淀的pH分别为:3.7,6.5,9.7。
(1)浸取过程中提高浸出效率可采用的措施有 (任答一条),ZnO和硫酸反应的化学方程式为 。
(2)加入适量锌粉的作用为:①使溶液中的Fe3+转化为Fe2+;② 。
(3)氧化过程中H2O2发生反应的离子方程式为 。
(4)加入适量Ca(OH)2调节溶液pH,促进Fe3+水解,Fe3+水解反应的平衡常数表达式K= ,Ca(OH)2不能过量的原因是 。
苯甲酸苯酯是重要的有机合成中间体,工业上用二苯甲酮制备苯甲酸苯酯。
制备苯甲酸苯酯的实验步骤为:
步骤1:将20mL浓H2SO4与40mL冰醋酸在下图装置的烧杯中控制在5℃以下混合。
步骤2:向烧杯中继续加入过硫酸钾25g,用电磁搅拌器搅拌4~5分钟,将二苯甲酮9.1g溶于三氯甲烷后,加到上述混合液中,控制温度不超过15℃,此时液体呈黄色。
步骤3:向黄色液体中加水,直至液体黄色消失,但加水量一般不超过1mL,室温搅拌5h。
步骤4:将反应后的混合液倒入冰水中,析出苯甲酸苯酯,抽滤产品,用无水乙醇洗涤,干燥
(1)步骤1中控制在5℃以下混合的原因为 。
(2)步骤2中为控制温度不超过15℃,向混合液中加入二苯甲酮的三氯甲烷溶液的方法是 。
(3)步骤3中加水不超过1mL,原因是 。
(4)步骤4中抽滤用到的漏斗名称为 。
(5)整个制备过程中液体混合物会出现褐色固体,原因是 ;除去该固体操作为 。
高分子纳米活性钛无霸是钛氧化物经过光照射,在其表面产生氧化性极强的活性离子,这种活性离子可以分解存在生活空间中的一些有害物质(甲醛、氮氧化物等)。
(1)Ti2+的基态价电子排布式为 。
(2)甲醛分子中C原子轨道杂化类型为 。1mol甲醛分子中含有σ键的数目为 。
(3)甲醛易溶于水,除因为它们都是极性分子外,还因为 。
(4)与N2O互为等电子体的一种分子为 (填化学式) 。
(5)某含钛化合物晶胞结构如图所示,该化合物的化学式为 。
氨气在生产、生活和科研中应用十分广泛
(1)传统工业上利用氨气合成尿素
①以CO2与NH3为原料合成尿素的主要反应如下:
2NH3(g)+CO2(g)=NH2CO2NH4(s)ΔH=-159.47 kJ·mol-1
NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)ΔH=+ 72.49 kJ·mol-1
反应2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g)ΔH= kJ·mol-1。
②液氨可以发生电离:2NH3(l) NH2- + NH4+,COCl2和液氨发生“复分解”反应生成尿素,写出该反应的化学方程式 。
NH2- + NH4+,COCl2和液氨发生“复分解”反应生成尿素,写出该反应的化学方程式 。
(2)氨气易液化,便于储运,可利用NH3作储氢材料
已知:2NH3(g) N2(g) + 3H2(g) ΔH=+92.4 kJ·mol-1
N2(g) + 3H2(g) ΔH=+92.4 kJ·mol-1
① 氨气自发分解的反应条件是 (填“低温” 或 “高温”)。
②其他条件相同,该反应在不同催化剂作用下反应,相同时间后,氨气的转化率随反应温度的变化如右图所示。
在600℃时催化效果最好的是 (填催化剂的化学式)。c点氨气的转化率高于b点,原因是 。
(3)垃圾渗滤液中含有大量的氨氮物质(用NH3表示)和氯化物,把垃圾渗滤液加入到如图所示的电解池(电极为惰性材料)进行电解除去NH3,净化污水。该净化过程分两步:第一步电解产生氧化剂,第二步氧化剂氧化氨氮物质生成N2。
①写出电解时A极的电极反应式: 。
②写出第二步反应的化学方程式: 。