碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用。
(1)真空碳热还原—氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
2Al2O3(s)+2AlCl3(g)+6C(s)=6AlCl(g)+6CO(g) △H=a kJ·mol-1
3AlCl(g) =2Al(l)+AlCl3(g) △H=b kJ·mol-1
反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H= kJ·mol-1(用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g) △H="Q" kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H="Q" kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 时间(min) 浓度(mol/L) |
0 |
10 |
20 |
30 |
40 |
50 |
| NO |
1.00 |
0.68 |
0.50 |
0.50 |
0.60 |
0.60 |
| N2 |
0 |
0.16 |
0.25 |
0.25 |
0.30 |
0.30 |
| CO2 |
0 |
0.16 |
0.25 |
0.25 |
0.30 |
0.30 |
①0~10min内,NO的平均反应速率v(NO)= ,T1℃时,该反应的平衡常数K= ;
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母编号)。
a.通入一定量的NO b.加入一定量的活性炭
c.加入合适的催化剂 d.适当缩小容器的体积
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则Q 0(填“>”或“<”)。
④在恒容条件下,能判断该反应一定达到化学平衡状态的依据是 (填选项编号)。
a.单位时间内生成2n mol NO(g)的同时消耗n mol CO2(g)
b.反应体系的温度不再发生改变
c.混合气体的密度不再发生改变
d.反应体系的压强不再发生改变
(3)铝电池性能优越,Al—Ag2O电池可用作水下动力电源,其原理如下图所示: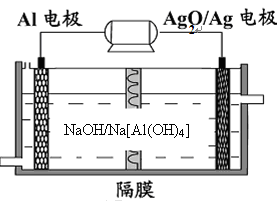
请写出该电池正极反应式 ;常温下,用该化学电源和惰性电极电解300ml硫酸铜溶液(过量),消耗27mg Al,则电解后溶液的pH= (不考虑溶液体积的变化)。
CuSO4溶液与K2C2O4溶液反应,得到一种蓝色结晶水合物晶体。通过下述实验确定该晶体的组成:
①称取0.1680g晶体,加入过量的H2SO4溶液,使样品溶解后加入适量水,加热近沸,用0.02000mol·L-1KMnO4溶液滴定至终点(溶液变为浅紫红色),消耗20.00mL。
②接着将溶液充分加热,使浅紫红色变为蓝色,此时MnO—4转化为Mn2+并释放出O2。
③冷却后加入2g KI固体(过量)和适量Na2CO3,溶液变为棕色并生成沉淀。
④用0.05000mol·L-1Na2S2O3溶液滴定,近终点加指示剂,滴定至终点,消耗10.00mL。
已知:2MnO—4+5H2C2O4+6H+==2Mn2++10CO2↑+8H2O
2Cu2++4I—=2CuI↓+I2
2Na2S2O3+I2=2NaI+Na2S4O6
(1)步骤②中发生反应的离子方程式为。
(2)步骤④中加入的指示剂为。
(3)通过计算写出蓝色晶体的化学式(写出计算过程)。
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
①已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1= +489.0 kJ/mol
C(石墨)+CO2(g)=2CO(g) ΔH2=+172.5 kJ/mol
则CO还原Fe2O3的热化学方程式为;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO。PdCl2被还原成单质,反应的化学方程式为;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2构成丙烷燃料电池。
①负极电极反应式是:;
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是(填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-=H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)  CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
|
| H2O |
CO |
CO2 |
|||
| 1 |
650 |
2 |
4 |
1.6 |
5 |
| 2 |
900 |
1 |
2 |
0.4 |
3 |
| 3 |
900 |
1 |
2 |
0.4 |
1 |
①该反应的正反应为(填“吸”或“放”)热反应;
②实验2中,平衡常数K=;
③实验3跟实验2相比,改变的条件可能是(答一种情况即可);
(4)将2.4g碳在足量氧气中燃烧,所得气体通入100mL 3.0mol/L的氢氧化钠溶液中,完全吸收后,溶液中所含离子的物质的量浓度由大到小的顺序。
(1)已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 |
HSCN |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数 |
1.3×10—1 |
1.8×10—5 |
4.9×10—10 |
K1=4.3×10—7 K2=5.6×10—11 |
①等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为
(填序号)。
②25℃时,将20 mL 0.1 mol·L—1 CH3COOH溶液和20 mL 0.1 mol·L—1HSCN溶液分别与20 mL 0.1 mol·L—1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是 。反应结束后所得两溶液中,c(CH3COO—)c(SCN—)(填“>”、“<”或“=”)
③若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是______(填序号)。
a. c(CH3COO-) b. c(H+) c. Kwd. 醋酸电离平衡常数
(2)下图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2—浓度、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是(填化学式)。向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+、Fe2+的溶液,振荡后,ZnS沉淀会转化为(填化学式)沉淀。
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50 mL 2 mol·L—1的氯化铜溶液的装置示意图:
请回答:
① 甲烷燃料电池的负极反应式是。
② 当线路中有0.1 mol电子通过时,极增重________g
工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g)  CH3OH(g)。
CH3OH(g)。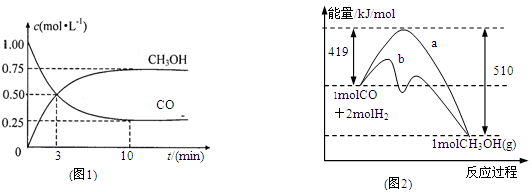
(1)图1是表示一定温度下,在体积为2L的密闭容器中加入4molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=
(2)图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。该反应是_________(选填“吸热”或“放热”)反应,写出反应的热化学方程式。
(3)该反应平衡常数K为______________,温度升高,平衡常数K_________(填“增大”、“不变”或“减小”)
(4)恒容条件下,下列措施中能使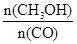 增大的有
增大的有
a.升高温度b.充入He气
c.再充入2 molH2d.使用催化剂
酸、碱、盐是化学工作者研究的重要领域,请回答下列各小题:(1)某二元酸H2X的电离方程式是:H2X=H++HX—,HX—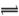 X2—+H+。回答下列问题:
X2—+H+。回答下列问题:
①KHX溶液显(填“酸性”、“碱性”或“中性”)。
②若0.1 mol·L—1KHX溶液的pH=2,则0.1 mol·L—1H2X溶液中氢离子的物质的量
浓度(填“<”、“>”或“=”)0.11 mol·L—1,理由是。
③0.01 mol·L—1的HCl与0.02 mol·L—1的KHX溶液等体积混合液中各离子浓度由大到小的顺序是 (2)在25℃下,向浓度均为0.1 mol·L—1的FeCl3和AlCl3混合溶液中逐滴加入氨水,先生成(填化学式)沉淀。已知25℃时Ksp[Fe(OH)3]=2.6×10—39 mol4·L—4,KsP[Al(OH)3]=1.3×10—33 mol4·L—4。
(2)在25℃下,向浓度均为0.1 mol·L—1的FeCl3和AlCl3混合溶液中逐滴加入氨水,先生成(填化学式)沉淀。已知25℃时Ksp[Fe(OH)3]=2.6×10—39 mol4·L—4,KsP[Al(OH)3]=1.3×10—33 mol4·L—4。
(3)在25℃下,有pH=3的醋酸溶液和pH=11的氢氧化钠溶液,其中氢氧化钠溶液的物质的量浓度是,醋酸溶液的物质的量浓度(填“>”、“<”、“=”)氢氧化钠溶液物质的量浓度。将上述两溶液等体积混合,反应后溶液显(填“酸”、“碱”、“中”)性。
(4)某强酸性反应体系中,发生反应:
X+PbO2+H2SO4 =Pb(MnO4)2+PbSO4+H2O ,
已知X是一种硫酸盐,且0.2 mol X在该反应中失去1 mol 电子,则X的化学式是
。请将上述化学方程式配平,把系数填在各物质前的横线上。.