某小组同学用盐酸和氢氧化钙,对酸和碱的中和反应进行探究.请你参与.
甲同学向装有氢氧化钙溶液的烧杯中加入盐酸,无明显现象.结论:两种物质未发生反应.
乙同学向滴有酚酞的氢氧化钙溶液的试管中慢慢滴加盐酸,溶液由
大家认为乙的实验证明盐酸与氢氧化钙发生了中和反应.并对甲的实验继续探究.
[提出问题]甲实验后的溶液中有什么溶质?
[作出猜想]猜想一,只有
;猜想二有
和
;猜想三,有
和
.
[实验探究]为验证猜想,丙同学设计了方案1和方案2,并按方案进行实验.
| 方案编号 |
方案1 |
方案2 |
方案3 |
| 实验操作(分别取少量甲实验后的溶液于试管中) |
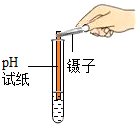 |
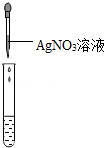 |
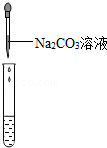 |
| 实验现象 |
对比标准比色卡:pH<7 |
产生白色沉淀 |
|
| 实验结论 |
溶液中有 | 溶液中有
|
[实验结论]丙认为猜想三正确.
[实验评价]丙的实验操作和方案中有不足之处,其不足之处是
大家讨论后通过方案3即证明了猜想三正确,其实验中应观察到的现象为
[实验拓展]为节约资源和避免实验废液对环境污染,小组同学将方案1和方案3及甲实验后烧杯中剩余溶液混合(混合时未见明显现象),并对混合液中的盐分离回收,请将相关内容填入下表.
| 要分离的盐 |
所用试剂 |
主要操作 |
|
|
|
|
(10四川甘孜24)人类生产和生活都离不开金属:
(1)指出金属铜的一个性质及其对应的用途:
性质,对应的用途。
(2) 要防止铁制品因锈蚀而报废,就要知道铁制品锈蚀的原因。铁制品锈蚀的条件是。
(3)为了验证铜、银、镁、铁的金属活动性顺序,小明同学设计如下实验方案:
a.将体积大小一样的镁片和铁片分别放入溶质质量分数和体积都相同的稀盐酸中;
b.将铜片放入到硝酸银溶液中。
请回答:
①在试验中运用“控制实验条件”来设计实验方案是学习化学的重要的科学方法。在步骤a中,所控制的实验条件是、、、。
②通过步骤a,可判断出镁的金属活动性比铁强,依据的实验现象是。
③步骤b中的实验现象是。
④小红同学认为i,小明同学的实验方案不足以说明铜、银、镁、铁的金属活动性顺序,还需要进行一个实验,该实验的方法是。
(10海南45)气焊和气割都需要用到乙炔。乙炔俗称电石气(化学式为C2H2),是一种无色无味的气体,密度比空气略小,难溶于水。实验室常用块状固体碳化钙与水反应制备乙炔,该反应比二氧化锰催化过氧化氢分解更加剧烈。请回答:
(1)乙炔的物理性质之一是;
(2)图中仪器a的名称是;
(3)从下图选择实验室制备乙炔所用仪器的最佳组合是(填序号)。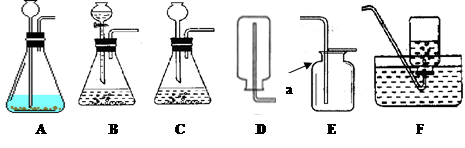
以下是实验室常用部分仪器: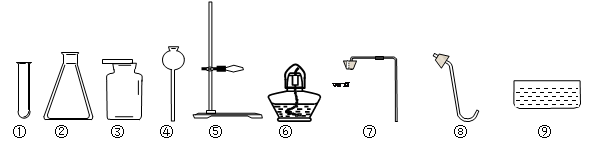
(1) 指出图中仪器的名称:④;
(2) 小李同学选择仪器制取并收集氧气,已知他使用了仪器①③⑤⑥,那么他还需要使用上图仪器中的(填序号);该发生装置检查气密性的方法是:把导管的一端浸在水里,用手紧贴试管外壁,若导管口有,则说明该装置不漏气。
(3)小张同学正在收集一瓶CO2, 不知是否收集满了,其验满方法是。
(10长沙47)将CO2通入NaOH溶液中无明显现象。某学习小组的同学为了观察到CO2与NaOH溶液反应的明显外观现象,并同时利用这一反应来验证质量守恒定律,设计了下列实验。请根据实验过程及内容,思考并回答相关问题。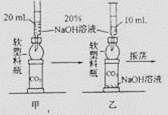
(1)实验装置如图甲所示。将整套装置(包括CO2及NaOH溶液)放在天平上称量,测得质量为78.2g。
(2)用力推压注射器活塞向密闭的软塑料瓶中注入10mLNaOH溶液(装置如图乙所示),振荡后观察到的现象有__________________________________。
(3)静置片刻后,将整套装置再次放在天平上称量,测得其质量仍为78.2g,你对这一结果的解析是______________________________________________。
(4)通过上述探究实验,你得到的启示是:①②
①若采用有气体参加或生成的反应来验证质量守恒定律,应让化学反应在____________中进行。
②为进一步证明CO2与NaOH溶液确已发生了化学反应,你还能想到的方法是__________________________________。
(10济宁2-6)(1)下图是实验室制备物质、探究物质性质的常用装置,请回答: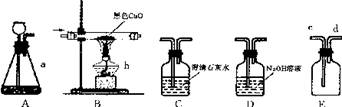
①仪器a、b的名称分别是____;
②连接装置A、E可用来制取氧气,装置A应与E的端连接,反应的化学方程式为
③除去CO中少量的C02,最好将气体通过装置,理由是;
④连接装置B、C可用来验证CO的还原性,CO通过装置B时可以看到,装置C中出现白色混浊,那么,装置B中发生反应的化学方程式为
(2)课外学习小组为进一步探究活泼金属与酸反应的情况,做了以下两组对比实验(见下图)。请分析实验I、Ⅱ后回答:
①实验I反映了同种金属跟不同酸反应的剧烈程度不同;实验Ⅱ则表明了____剧烈程度不同,原因是
②按照实验I和Ⅱ设计思路,请你再设计一组对比实验,简述实验方案。