发展“碳一化学”,开发利用我国相对丰富的煤炭资源具有重要的战略意义和经济价值。下面是以焦炭为原料,经“碳一化学”途径制取乙二醇的过程:
(1)该过程中产生的的CO可继续与水蒸气发生可逆反应得到CO2和H2,此反应的平衡常数表达式K =____________。
(2)CH3OH(l)气化时吸收的热量为27 kJ/mol,CH3OH(g)的燃烧热为677 kJ/mol,请写出CH3OH(l)完全燃烧的热化学方程式_________________。
(3) “催化还原”反应制乙二醇原理如下:
CH3OOC-COOCH3(g)+4H2(g)  HOCH2-CH2OH(g)+2CH3OH(g) △H =" -34" kJ/mol
HOCH2-CH2OH(g)+2CH3OH(g) △H =" -34" kJ/mol
为探究实际生产的最佳条件,某科研小组进行了多方面研究。下图表示乙二醇达到平衡时的产率随原料投料比[n(氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5 MPa、2.5 MPa、3.5 MPa的情况,则曲线甲对应的压强是P(甲)=___________。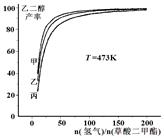
(4)草酸二甲酯水解产物草酸(H2C2O4)为二元中强酸
① 草酸氢钾溶液中存在如下平衡:
H2O H++OH-、HC2O4-
H++OH-、HC2O4- H++C2O42-和 。
H++C2O42-和 。
② 向0.1 mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是 (填序号)。
a.c(K+) = c(HC2O4-) + c(H2C2O4) + c(C2O42-)
b.c(K+) + c(Na+) = c(HC2O4-) + c(C2O42-)
c.c(Na+) = c(H2C2O4) + c(C2O42-)
d.c(K+) > c(Na+)
(5)以甲醇为原料,使用酸性电解质构成燃料电池,该燃料电池的负极反应式为 ;若以甲烷代替该燃料电池中的甲醇,向外界提供相等电量,则每代替32 g甲醇,所需标准状况下的甲烷的体积为 L。
有以下物质:
①NaOH②Na2O2 ③HClO④MgCl2⑤K2SO4⑥Ne(用序号做答)
(1)只含有离子键的是;(2)只含有共价键的是;
(3)没有化学键的是;(4)既有离子键,又有非极性共价键的是;
(5)属于共价化合物的是;
(6)属于离子化合物且阴阳离子个数比为2:1的是。
“温室效应”是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
(1)下列措施中,有利于降低大气中CO2浓度的有:。(填字母)
a.减少化石燃料的使用 b.植树造林,增大植被面积
c.采用节能技术 d.利用太阳能、风能
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如: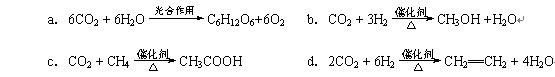 以上反应中,最节能的是,原子利用率最高的是。
以上反应中,最节能的是,原子利用率最高的是。
(3)文献报道某课题组利用CO2催化氢化制甲烷的研究过程如下:
反应结束后,气体中检测到CH4和H2,滤液中检测到HCOOH,固体中检测到镍粉和Fe3O4。CH4、HCOOH、H2的产量和镍粉用量的关系如下图所示(仅改变镍粉用量,其他条件不变):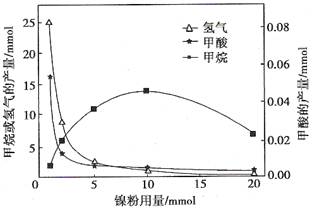
研究人员根据实验结果得出结论:
HCOOH是CO2转化为CH4的中间体,即: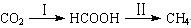
①写出产生H2的反应方程式。
②由图可知,镍粉是。(填字母)
a.反应Ⅰ的催化剂 b.反应Ⅱ的催化剂 c.反应Ⅰ、Ⅱ的催化剂 d.不是催化剂
③当镍粉用量从1 mmol增加到10 mmol,反应速率的变化情况是。(填字母)
a.反应Ⅰ的速率增加,反应Ⅱ的速率不变
b.反应Ⅰ的速率不变,反应Ⅱ的速率增加
c.反应Ⅰ、Ⅱ的速率均不变
d.反应Ⅰ、Ⅱ的速率均增加,且反应Ⅰ的速率增加得快
e.反应Ⅰ、Ⅱ的速率均增加,且反应Ⅱ的速率增加得快
f.反应Ⅰ的速率减小,反应Ⅱ的速率增加
(8分)以乙烯为原料合成化合物C的流程如下所示:
(1)写出A的结构简式。
(2)反应①④的反应类型分别为、。
(3)写出反应②和④的化学方程式:
②;④。
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题: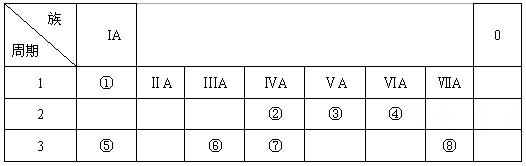

(1)④、⑤、⑥的原子半径由大到小的顺序为_________________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_________________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的溶液易被催化分解,可使用的催化剂为(填序号)_________________。
a.MnO2b.FeCl3 c.Na2SO3 d.KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应: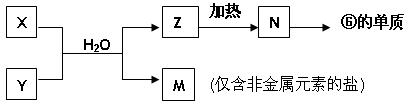
X溶液与Y溶液反应的离子方程式为_______________________________,
N→⑥的单质的化学方程式为______________________________________。
请选择合适方法的字母代号填空
(1)从煤焦油中提取二甲苯(2)从海水中提取粗盐
(3)丁烷转变为乙烷和乙烯(4)从铁矿石中提取金属铁
(5)煤转化为焦炭、煤焦油等
(6)提纯氢氧化铁胶体(除去其中的杂质离子)
| A.过滤 | B.裂解 | C.分馏 | D.裂化 E、干馏 F、还原 G、电解 H、渗析 |
I、蒸发 J、氧化