直接排放氮氧化物会形成酸雨、雾霾,催化还原法和氧化吸收法师常用的处理方法。
(1)用化学方程式表示NO2形成酸雨的过程____________________________
(2)利用NH3和CH4等气体除去烟气中的氮氧化物。
①NH3的电子式
②热稳定性 NH3 CH4(填“>”=“<”)
③已知:CH4(g)+2O2(g)=CO2(g)+2H20(l) △H1=akJ/mol; 欲计算反应CH4(g)+4NO(g)=CO2(g)+2H20(l)+2N2(g)的焓变 △H2则还需要查询某反应的焓变△H3,当反应中各物质的化学计量数之比为最简整数比时,△H3=bkJ/mol,该反应的热化学方程式是__________________________据此计算出△H2= kJ/mol (用含a、b的式子表示)。
(3)利用氧化法除去烟气中的氮氧化物。首先向氮氧化物中补充氧气,然后将混合气体通入石灰乳中,使之转化为硝酸钙。已知某氮氧化物由NO和NO2组成,且n(NO):n(NO2)=1:3.写出氧化吸收法除去氮氧化物的化学方程式______________________________________现有标况下的O233.6ml,理论上可以处理该氮氧化物______ml(标准状况下)。
某些铁、铝制品的表面常生成一层氧化物,其主要成分分别是氧化铁、氧化铝。两种氧化物均能与盐酸反应,生成的两种盐的化学式分别为_____________、____________。向这两种盐的溶液中分别滴加足量氢氧化钠溶液,可观察到:其中一种溶液中的现象是先产生白色沉淀,然后白色沉淀逐渐消失则该溶液为_____________溶液;另一种溶液中的现象是______(填序号)。
①产生白色沉淀
②产生红褐色沉淀
③产生白色沉淀,迅速变成灰绿色,最后变成红褐色
印刷电路板是由塑料和铜箔复合而成,刻制印刷电路时要用FeCl3溶液作为“腐蚀液”,生成CuCl2和FeCl2,其反应的化学方程式如下:Cu+ 2FeCl3═ CuCl2 + 2FeCl2
(1)指出上述反应中氧化剂是__________,还原剂是__________。
(2)使用过的腐蚀液会失效,但还可以回收利用,其中有一步需要将Fe2+转化为Fe3+,下列试剂能实现上述变化的是_______(填序号)。
| A.氯气 | B.铁 | C.盐酸 | D.稀硫酸 |
在Cl2、NO、SO2、NO2、NH3五种气体中,与空气相遇能立即变色的是_________;
常用于自来水杀菌、消毒的是________;能用向下排空气法收集的是__________;溶于水后能生成强酸的是_________。
已知在柑橘、柠檬等水果中含有柠檬酸,且已知柠檬酸中只含C、H、O三种元素。 现对该物质进行研究,以测得其结构。
(1)取柠檬酸19.2 g,在氧气中完全燃烧,产生CO2和H2O分别为26.4 g和7.2 g,进行质谱分析,可获得柠檬酸的相对分子质量为192,通过计算,可获得柠檬酸的分子式为____________。
(2)利用__________________分析可知柠檬酸分子中含有—COOH和—OH。
(3)再利用核磁共振氢谱分析发现有4个吸收峰,其峰面积之比为4∶2∶1∶1。综合以上信息,写出柠檬酸的结构简式__________________________________。
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=+260 kJ·mol-1
已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
则CH4与O2反应生成CO和H2的热化学方程式为_________________;
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。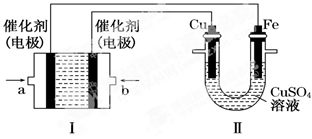
①a处应通入(填“CH4”或“O2”),a处电极上发生的电极反应式是_______________;
②电镀结束后,装置Ⅰ中KOH溶液的浓度(忽略溶液体积的变化)_______(填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度________;
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有__________;
④在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗甲烷________L(标准状况下)。