(14分)
LiPF6是锂离子电池中广泛应用的电解质。某工厂用LiF、PCl5为原料,低温反应制备LiPF6,其流程如下: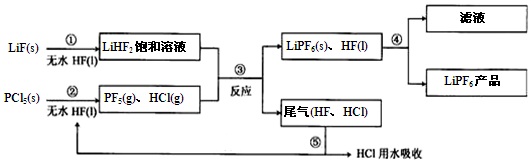
已知:HCl的沸点是-85.0 ℃,HF的沸点是19.5 ℃。
(1)第①步反应中无水HF的作用是 、 。反应设备不能用玻璃材质的原因是 (用化学方程式表示)。无水HF有腐蚀性和毒性,工厂安全手册提示:如果不小心将HF沾到皮肤上,可立即用2%的 溶液冲洗。
(2)该流程需在无水条件下进行,第③步反应中PF5极易水解,其产物为两种酸,写出PF5水解的化学方程式: 。
(3)第④步分离采用的方法是 ;第⑤步分离尾气中HF、HCl采用的方法是 。
(4)LiPF6产品中通常混有少量LiF。取样品wg。测得Li的物质的量为nmol,则该样品中LiPF6的物质的量为 mol(用含有w、n的代数式表示)。
(1)中国古代四大发明之一--黑火药,它的爆炸反应为:
①除
外,上列元素的电负性从大到小依次为。
②在生成物中,
的晶体类型为,含极性共价键的分子的中心原子轨道杂化类型为。
③已知
与
结构相似,推算
分子中
键与
键数目之比为。
(2)原子序数小于36的元素
和
,在周期表中既处于同一周期又位于同一族,且
原子序数
比多2。
的基态原子外围电子(价电子)排布为,
的未成对电子数是。
(3)在
的水溶液中,一定条件下存在组成为
(
和
均为正整数)的配离子,将其通过氢离子交换树脂(
),可发生离子交换反应:
交换出来的
经中和滴定,即可求出
和
,确定配离子的组成。
将含0.0015
的溶液,与
完全交换后,中和生成的
需浓度为0.1200
溶液25.00
,呆知该配离子的化学式为
、 、 、 、 是原子序数依次增大的短周期主族元素, 、 在周期表中的相对位置如右表; 元素最低负化合价的绝对值与其原子最外层电子数相等; 是地壳中含量最多的金属元素。
(1)
的离子结构示意图为;元素
在周期表中位于第族。
(2)
和氢组成的化合物分子有6个原子,其结构简式为。
(3)
和
形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为
(4)
的最简单气态氢化物甲的水溶液显碱性。
①在微电子工业中,甲的水溶液可作刻蚀剂
的清除剂,所发生反应的产物不污染环境,其化学方程式为。
②一定条件下,甲在固定体积的密闭容器中发生分解反应(
>0)并达平衡后,仅改变下表中反应条件
,该平衡体系中随
递增递减的是
(选填序号)。
| 选项 |
||||
| 温度 |
温度 |
加入
的物质的量 |
加入甲的物质的量 |
|
| 甲的物质的量 |
平衡常数K |
甲的转化率 |
生成物物质的量总和 |
(5)由 、 形成的液态化合物 0.2 在 中完全燃烧,生成两种气态氧化物,298 时放出热量215 。 该反应的热化学方程式为。
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是
,并含少量的
、
、
等,生产工艺流程示意如下:

(1)将菱锌矿研磨成粉的目的是。
(2完成"氧化除铁"步骤中反应的离子方程式:
++=
+
(3)针铁矿(
)是以德国诗人歌德(
)名字命名的,组成元素是
、
和
,化学式量为89,化学式是。
(4)根据下表数据,调节"滤液2"的
时,理论上可选用的最大区间为。
| 开始沉淀的 | 10.4 |
6.4 |
- |
- |
| 沉淀完全的 | 12.4 |
8.0 |
- |
- |
| 开始溶解的 | - |
10.5 |
- |
- |
| 5.6×10-12 |
- |
6.8×10-5 |
2.8×10-9 |
(5)工业上从"滤液3"制取
过程中,合适的反应物是(选填序号)。
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)"滤液4"之后的操作依次为、、过滤,洗涤,干燥。
(7)分析图中数据,菱锌矿粉中
的质量分数不低于。
从樟科植物枝叶提取的精油中含有下列甲、乙、丙三种成分:


(1)甲中含氧官能团的名称为。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
其中反应Ⅰ的反应类型为,反应Ⅱ的化学方程式为(注明反应条件)。
(3)已知: 由乙制丙的一种合成路线图如下(A~F均为有机物,图中Mr表示相对分子质量):
由乙制丙的一种合成路线图如下(A~F均为有机物,图中Mr表示相对分子质量):
①下列物质不能与C反应的是(选填序号)
a.金属钠 b.
c.
溶液 d. 乙酸
②写出F的结构简式。
③D有多种同分异构体,任写其中一种能同时满足下列条件的异构体结构简式。
a.苯环上连接着三种不同官能团 b. 能发生银镜反应
c.能与
/
发生加成反应 d。遇
溶液显示特征颜色
④综上分析,丙的结构简式为。
碳酸锂广泛应用于陶瓷和医药等领域。已
-锂辉石(主要成分为
)为原材料制 备
的工艺流程如下:
备
的工艺流程如下:

已知:
、
、
和
以氢氧化物形式完全沉淀时,溶液的
分别为3.2、5.2、9.7和12.4;
、
和
在303
下的溶解度分别为34.2
、12.7
和1.3
。
(1)步骤Ⅰ前,
锂辉石要粉碎成细颗粒的目的是.
(2)步骤Ⅰ中,酸浸后得到的酸性溶液中含有
,另含有
等杂质,需在搅拌下加入(填"石灰石"、"氯化钙"或"稀硫酸")以调节溶液的
到6.0~6.5,沉淀部分杂质离子,然后分离得到浸出液。
(3)步骤Ⅱ中,将适量的
溶液、石灰乳和
溶液依次加入浸出液中,可除去的杂技金属离子有。
(4)步骤Ⅲ中,生成沉淀的离子方程式为。
(5)从母液中可回收的主要物质是。