某化学兴趣小组利用图一装置制取氨气并探究氨气的有关性质。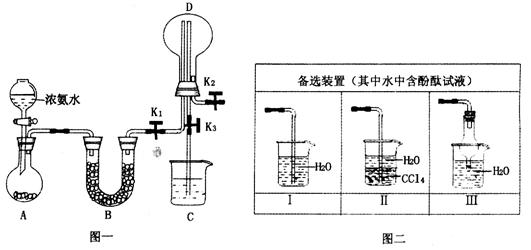
(1)装置A中烧瓶内试剂可选用________(填序号)
a.碱石灰 b.浓硫酸 c.生石灰 d.五氧化二磷 e.烧碱
(2)若探究氨气的溶解性,需在K2的导管末端连接图二装置中的_____装置(填序号),当装置D中集满氨气后,关闭K1、K2,打开K3,引发喷泉的实验操作是______________
___________________________________________________________________________。
(3)若探究氨气的还原性,需打开K1、K2,K3处导管连接制取纯净、干燥氯气的装置。
①用二氧化锰与浓盐酸制取氯气,生成气体必须通过盛有____________试剂的洗气瓶;
②D中氨气与氯气反应产生白烟,同时生成一种无色无味的气体,该反应的化学方程式为___________________________________;
③从K3处导管逸出的气体中含有少量Cl2,则C装置中应盛放_________溶液(填化学式),反应的离子方程式为____________________________________。
(8分)在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2。回答下列问题:
(1)I、II、III、IV装置可盛放的试剂是
I;II;III;IV(将下列有关试剂的序号填入空格内)
| A.品红溶液 | B.NaOH溶液 | C.浓硫酸 | D.酸性KMnO4溶液 |
(2)能说明SO2气体存在的现象是。
(3)使用装置II的目的是。
(4)使用装置III的目的是。
(5)确定含有乙烯的现象是。
(14分)透明聚酯玻璃钢可用于制造导弹的雷达罩和宇航员使用的氧气瓶。制备它的一种配方中含有下列四种物质:
填写下列空白:
(1)甲中不含氧原子的官能团名称是________;下列试剂能与甲反应而褪色的是________(填标号)。
a.Br2/CCl4溶液 b.石蕊溶液 c.酸性KMnO4溶液
(2)甲的同分异构体有多种,写出其中一种不含甲基的羧酸的结构简式:________________。
(3)淀粉通过下列转化可以得到乙(其中A~D均为有机物):
淀粉稀硫酸△AB浓硫酸170 ℃CDNaOH溶液△乙
A的分子式是________,试剂X可以是________。
(4)已知:
利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是________________________________。
(5)化合物丁仅含碳、氢、氧三种元素,相对分子质量为110。丁与FeCl3溶液作用显现特征颜色,且丁分子中烃基上的一氯取代物只有一种。则丁的结构简式为________。
(12分)实验室制取乙烯: 浓H2SO4170 ℃C2H4↑+H2O常因温度过高而使乙醇和浓H2SO4反应生成少量SO2。有人设计下列实验以确认上述混合气体中有乙烯和SO2。
浓H2SO4170 ℃C2H4↑+H2O常因温度过高而使乙醇和浓H2SO4反应生成少量SO2。有人设计下列实验以确认上述混合气体中有乙烯和SO2。
(1)各装置盛放的试剂是:Ⅰ______,Ⅱ______,Ⅲ________,Ⅳ________(将有关试剂的序号填在横线上)。
| A.品红溶液 | B.NaOH溶液 |
| C.浓H2SO4溶液 | D.酸性KMnO4溶液 |
(2)能说明SO2气体存在的现象是__________________。
(3)使用装置Ⅱ的目的是________________________________________________,
使用装置Ⅲ的目的是________________。
(4)确认含乙烯的现象是________________________________________________。
某化学课外小组为了探究CaCl2溶液和Na2SO4溶液反应有没有限度,设计了如下活动过程,请完成表中空格:(已知CaSO4在水中微溶,CaCO3在水中难溶)
| 实验步骤 |
向3—4 mL 1 mol/L的CaCl2溶液中滴入1mol/L的Na2SO4溶液至反应完全。 |
| 实验现象 |
产生白色沉淀 |
| 离子方程式 |
(1) |
| 小组讨论交流 |
向上述反应后的清液中滴入适量1mol/L的Na2CO3溶液会出现什么现象 |
| 假设出现的实验现象,说明理由 |
假设Ⅰ: 无现象; 理由:反应没有限度,Ca2+沉淀完全 假设Ⅱ:(2),理由:(3) |
| 证明你的假设 |
现象:产生大量的白色沉淀 |
| 离子方程式 |
(4) |
| 实验结论 |
(5) |
某学习小组,用稀HNO3与大理石反应过程中质量减小的方法,探究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.00 mL、大理石用量为10.00 g。
实验设计如表:
| 编号 |
T/K |
大理石规格 |
HNO3浓度 |
| ① |
298 |
粗颗粒 |
2.00 mol·L-1 |
| ② |
298 |
粗颗粒 |
1.00 mol·L-1 |
| ③ |
308 |
粗颗粒 |
2.00 mol·L-1 |
| ④ |
298 |
细颗粒 |
2.00 mol·L-1 |
将相应的实验目的填入下列空格中:
(1)实验①和②探究对该反应速率的影响;
(2)实验①和③探究对该反应速率的影响;
(3)实验①和④探究对该反应速率的影响