某校学生用碳酸钠溶液鉴别稀盐酸、食盐水和澄清石灰水.请你帮他完成下列实验探究.
【进行实验】
| 操作步骤 |
实验现象 |
实验结论 |
| 分别用
,
,
三支试管取样,然后各加入适量碳酸钠溶液 |
中
中 |
中的物质是食盐水 中的物质是稀盐酸 中的物质是澄清石灰水 |
写出
中反应的化学方程式
【发现问题】如何处理上述废液才能减少对环境的污染?
【思考与分析】应先对废液中的溶质成分进行探究,后制定方案.
【实验与探究】
(1)甲同学将所有废液倒入乙洁净烧杯中,静置后得到上层清液.
(2)取少量清液加入足量的氯化钡溶液(中性),出现白色沉淀,静置 后向溶液再滴加几滴无色酚酞溶液,溶液变为红色.由此现象说明甲同学所得上层清液中一定含有
【方法和应用】以上探究的结论启示我们,处理上述废液的正确方法是
已收集满的一瓶无色无毒气体。请你用学过的知识进行探究,确定该气体可能是什么气体。
| 假设(猜想) |
验证方法及操作 |
可能看到的现象 |
结论 |
(4分)载人航天工程有许多问题需要解决,舱内气体净化就是其中之一。某化学兴趣小组准备探究二氧化碳转化成氧气的方法。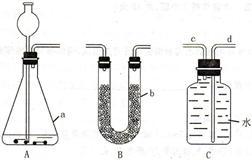
【查阅资料】
超氧化钾固体(化学式KO2)可作氧气源,用于呼吸面罩,供水下、矿井、高山、高空作业时使用。利用它能与二氧化碳反应放出氧气的原理,可作为密闭系统(如潜艇、宇宙太空舱等)的氧气再生剂。
【提出问题】
超氧化钾与二氧化碳反应除了生成氧气以外,还生成什么?
【猜想与假设】(1)根据化学反应前后元素种类不变,超氧化钾与二氧化碳反应的产物是氧气和化合物X,X中一定含 元素。
【实验验证】
(2)兴趣小组同学设法排尽A中的原有空气后依次连接装置A、B、C进行实验(仪器b为U型管,超氧化钾)。装置A的作用是 ;
按装置A,B,C依次连接,在C装置的后面连接一个量筒,收集氧气所排出的水,可以粗略测量氧气体积,但小敏经过多次实验发现,利用该装置测得生成氧气体积偏大的最主要原因是 。
(3)小米同学在B装置和C装置之间连接一个与装置C相同洗气瓶,瓶中放半瓶澄清石灰水,反应刚开始瓶中出现很多气泡但石灰水几乎没有浑浊,但是过了一段时间后,石灰水出现较大量的浑浊,这现象说明什么 。
被称为“生命之源”的水和被称为“绿色氧化剂”的双氧水(过氧化氢溶液),通常情况下均为无色液体。在化学实验开放日,实验小组的同学用下面的方法鉴别水和双氧水两瓶无色液体,请填写有关内容:
| 实验步骤 |
实验现象 |
实验结论 |
| ①取少量的两种无色液体分别加入A、B两个试管中; ②_________________________ ______________________________。 |
A试管中___________ ___________________ B试管中试管中有气泡产生 |
A试管中的无色液体是: _________________; B试管中的无色液体是: __________________。 |
(1)B试管中发生反应的符号表达式:________________________________________。
(2)如何验证B试管中产生的气体(写出操作步骤、实验现象和结论)?
___________________________________________________________________________。
某同学设计实验证明:酸与碱发生中和反应时有水生成。请帮助其完成实验报告:
| 实验操作步骤 |
实验现象 |
解释、结论与化学方程式 |
| ⑴取少量CuSO4粉末,向其中滴加几滴水 |
CuSO4粉末 |
化学方程式: |
| ⑵向盛有无水醋酸的干燥试管中加入CuSO4粉末;另取一支干燥试管,向其中加入和。 |
CuSO4粉末 |
实验说明: |
| ⑶将固体氢氧化钠加入盛有无水醋酸和CuSO4的试管里 |
CuSO4粉末 |
结论: NaOH与醋酸反应有水生成 |
某化学兴趣小组为证明鸡蛋壳的主要成分是碳酸盐。进行下列实验:
选择实验用具及药品
用具:试管、铁架台(带铁夹)、单孔橡皮塞、玻璃导管、橡皮管、捣碎的鸡蛋壳。
药品应选用______________________________________________________________
实验内容与记录(装置气密性已检查)
| 实验内容步骤 |
观察到的现象 |
结论、化学方程式 |
| 结论: |
||
| 结论: 化学方程式: |