工业上以锂辉石(Li2O·A12O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下: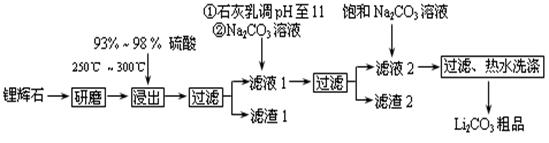
已知:①Li2O·Al2O3·4SiO2 + H2SO4(浓)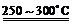 Li2SO4 + Al2O3·4SiO2·H2O↓
Li2SO4 + Al2O3·4SiO2·H2O↓
| T/℃ |
20 |
40 |
60 |
80 |
| S(Li2CO3)/g |
1.33 |
1.17 |
1.01 |
0.85 |
| S(Li2SO4)/g |
34.2 |
32.8 |
31.9 |
30.7 |
(1)从滤渣1中分离出Al2O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。则步骤Ⅱ中反应的离子方程式是 。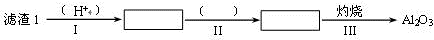
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3,写出生成滤渣2反应的离子方程式: 。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是 。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下。
①将粗产品Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择半透膜隔开,用惰性电极电解。阳极的电极反应式是 。
②电解后向产品LiOH溶液中加入过量NH4HCO3溶液生成Li2CO3反应的化学方程式是 。
(1)某学生欲用11.9 mol·L-1的浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol·L-1的稀盐酸。该学生需要量取______________mL浓盐酸进行配制。(保留小数点后1位)
(2)容量瓶是配制溶液的必需仪器。下列关于容量瓶及其使用方法的叙述,错误的是
①是配制一定物质的量浓度的溶液的专用仪器
②使用前要先检查容量瓶是否漏液
③容量瓶可以用来加热
④不能用容量瓶长期贮存配制好的溶液
⑤可以用500mL容量瓶配制250mL溶液
⑥容量瓶上标有的是温度 、容量 、刻度线
a.① ③ b.① ④c.③ ⑤d.⑤ ⑥
(3)①该同学用配制的0.400 mol·L-1的盐酸,中和含0.4 g NaOH的NaOH溶液,则该同学需取___________mL盐酸。
②假设该同学用新配制的盐酸中和含0.4 g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是_________________。
a.浓盐酸挥发,浓度不足
b.配制溶液时,未洗涤烧杯
c.配制溶液时,俯视容量瓶刻度线
d.加水时超过刻度线,用胶头滴管吸出
利用化合价和物质类别推测物质的性质是化学研究的重要手段。
(1)从化合价的角度可以预测物质的性质。
①SO2的性质___________(填序号,下同);
A.只有氧化性 B.只有还原性 C.既有氧化性又有还原性
②将SO2通入酸性KMnO4溶液中,溶液由紫色褪至无色。反应结束后,硫元素存在形式合理的是__________。
A.S2— B.S C.SO32— D.SO42—
(2)从物质分类的角度可以推测物质的性质。现有由MgO、Al2O3、Fe2O3、SiO2组成的某混合物试样。
①其中Al2O3属于_____________氧化物,MgO和Fe2O3属于____________氧化物(填“酸性”、“碱性”或“两性”);
②将试样溶于过量的盐酸中,过滤,滤渣的主要成分是____________;再向滤液中加入NaOH溶液至过量,过滤,滤渣中的主要成分是_______________;
③若将该试样直接溶于过量的NaOH溶液中,所发生的反应的化学方程式是______________________(可任意写其中一个)。
利用硫酸厂烧渣(含铁的氧化物和少量FeS及SiO2)制碱式硫酸铁的流程如下:
(1)SO2与过量NaOH溶液反应的离子方程式为 。
(2)滤渣的主要成分为 (填化学式)。
(3)反应1中加双氧水的目的是 。
(4)碱式硫酸铁的化学式为Fex(OH)y(SO4)z·nH2O,为确定其组成进行如下实验:
①称取1.6920 g 样品溶于足量的稀盐酸中;
②加足量的BaCl2溶液,过滤、洗涤、干燥、称重,得固体质量为2.3300 g;
③向步骤②的滤液中加过量的NaOH溶液,过滤、洗涤、灼烧、称重,得固体质量为0.6400 g。
根据以上实验数据计算碱式硫酸铁样品中的n(OH-): n(SO42-)(写出计算过程)
结合氯气的相关知识解决下列问题。
(1)在实验室中制取Cl2,下列收集Cl2的正确装置是 (填字母)。
将Cl2通入水中,所得溶液中具有氧化性的含氯粒子有 。
(2)氯气可用于生产漂白粉。由于盐酸浓度不同,漂白粉与盐酸混合发生反应的反应类型不同。
漂白粉与稀盐酸发生复分解反应,离子方程式为 。
漂白粉与浓盐酸发生氧化还原反应,离子方程式为 。
(3)某实验小组向100mL FeI2溶液中逐渐通入Cl2,会依次发生如下反应:
a.Cl2+2I-=2Cl-+I2
b.Cl2+2Fe2+=2Cl-+2Fe3+
c.5Cl2+I2+6H2O=10Cl-+2IO3-+12H+
其中Fe3+、I2的物质的量随n(Cl2)的变化如图所示。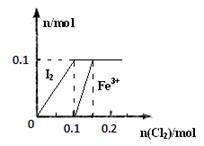
请回答下列问题:
①当n(Cl2)=0.12mol时,不考虑水的电离及金属离子的水解,分析溶液中所含金属阳离子及其
物质的量 (写出计算过程,否则不得分)。
②当溶液中n(Cl-):n(IO3-)=8:1时,通入的Cl2在标准状况下的体积为 L(写出计算过程,否则不得分)。
在下图所示的一些常见单质、化合物等物质之间的转化关系中(有些反应的条件和部分物质未全部列出),已知在常温常压下,F为红棕色气体;L为白色不溶于水的固体,它既能与盐酸反应又能与氢氧化钠反应;G是硝酸;J是无色气体,且能够使燃着的木条熄灭;A为金属单质,其氧化物具有两性;D为非金属气态单质,是大气中含量最多的物质;H为非金属固态单质,其原子核中有6个质子。
(1)化合物C的化学式为______________。
(2)物质I在生产生活中的用途有_______________(任答一条)。
(3)写出E+氧气→F的化学方程式:________________________。
(4)写出A与稀盐酸反应的离子方程式:____________________。