硫及其化合物有广泛的应用,对SO2性质的研究是高中化学教学的一项重要内容。
I.对比研究是一种重要的研究方法。若将硫的单质及部分化合物按如下表所示分成3 组,则第2组中物质M的化学式是 。
| 第1组 |
第2组 |
第3组 |
| S (单质) |
SO2、H2SO3、M、NaHSO3 |
SO3、H2SO4、Na2SO4、 NaHSO4 |
Ⅱ.某校化学学习小组用下图所示的实验装置研究SO2气体还原Fe3+、Br2的反应。
(1)下列实验方案可以用于在实验室制取所需SO2的是 。
A.Na2SO3溶液与HNO3 B.Na2SO3固体浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热的浓硫酸
(2)装置C的作用是除去多余的SO2,防止污染空气。已知在用氢氧化钠溶液吸收SO2的 过程中,往往得到Na2SO3和NaHSO3的混合溶液,常温下,溶液pH随n(SO32—):n(HSO3—)变化关系如下表
| n(SO32—):n(HSO3—) |
91:9 |
1:1 |
9:91 |
| pH |
8.2 |
7.2 |
6.2 |
当吸收液中n(SO32—):n(HSO3—) =10:1时,溶液中离子浓度关系正确的是 。
A.c(Na+)+ c(H+)= 2c(SO32—)+ c(HSO3—)+ c(OH—)
B.c(Na+)>c(HSO3—)>c(SO32—)>c(OH—)>c(H+)
C.c(Na+)>c(SO32—)>c(HSO3—)>c(OH—)>c(H+)
(3)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中反应后的溶液分成三份,并设计了如下探究实验,请你评价并参与他们的探究过程(限选试剂:KMnO4溶液、KSCN溶液、BaCl2溶液、稀硫酸、稀盐酸、稀硝 酸、Ba(NO3)2溶液、新制的氯水)
| 序号 |
实验方案 |
实验现象 |
结论 |
| 方案① |
往第一份试液中加入KMnO4溶液溶液 |
紫红色褪去 |
SO2与Fe3+反应生成了Fe2+ |
| 方案② |
往第二份试液中加入 |
|
SO2与Fe3+反应生成了Fe2+ |
| 方案③ |
往第二份试液中加入 |
|
SO2与Fe3+反应生成了SO42— |
上述方案①得出的结论是否合理 ,原因 。
如果他们设计的方案②与方案③均合理并且得到相应结论,请你将上面表格补充完整。
(4)装置B中能表明Br—的还原性弱于SO2的现象是 。
绿矾(FeSO4·7H2O)、硫酸亚铁铵(FeSO4·(NH4 )2SO4·6H2O)是重要的化学化工试剂。工业上常利用机械加工行业产生的废铁屑为原料制备。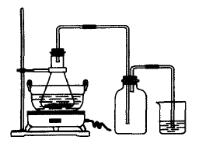
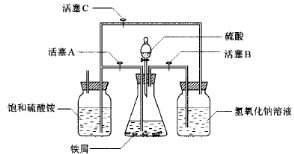
图Ⅰ图Ⅱ
请回答下列问题:
(1)图Ⅰ用于制备绿矾。其中锥形瓶中盛放的药品或原料是__________,集气瓶的作用是__________;烧杯中主要发生:①CuSO4+H2S=CuS↓+H2SO4②4CuSO4+PH3+4H2O=H3PO4+4H2SO4+4Cu↓,则烧杯中盛放的试剂是___ ___,其作用是_______________。
(2)图Ⅱ用于制备硫酸亚铁铵。在0~60℃的温度范围内,硫酸亚铁铵在水中的溶解度比硫酸铵、硫酸亚铁的溶解度小,冷却混合液至室温便析出硫酸亚铁铵。具体操作:①打开活塞____________,关闭活塞_________,从分液漏斗滴入6 mol·L-1 H2SO4到250 mL锥形瓶,充分反应。②待锥形瓶中的铁屑快反应完时,关闭活塞________,打开活塞________。③放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵。
(3)在制备硫酸亚铁的过程中,理论上控制铁过量或酸过量均有利于防止Fe2+被氧化。设计两个实验:实验一,控制酸过量;实验二,控制铁过量;其余步骤同,制得硫酸亚铁铵,并对产品质量进行检测。检测结果如下:
| 序号 |
反应物用量 |
产品质量 |
| 1 |
n(H2SO4):n(Fe)>1:1 |
介于Ⅰ级~Ⅱ级之间 |
| 2 |
n(H2SO4):n(Fe)<1:1 |
优于Ⅰ级 |
已知产品质量标准:Fe3+的质量分数等于0.005%,产品质量定为Ⅰ级;Fe3+的质量分数等于0.01%,产品质量定为Ⅱ级,从实验结果中,可得出制备硫酸亚铁溶液时,反应控制___________过量为最佳。
小刚同学探究二氧化硫分别与BaCl2溶液、Ba(OH)2溶液反应的实验。
(1)少量SO2通入到Ba(OH)2溶液中的离子反应方程式为,过量的SO2通入到Ba(OH)2溶液中的离子反应方程式为。
(2)请回答有关问题。小刚同学将SO2通入到BaCl2溶液中,出现了异常现象,看到了明显的白色沉淀,为探究该白色沉淀的成分,他设计了如下实验流程:
则操作①的名称为,试剂A的化学式为。
(3)实验表明,小刚加入试剂A后,白色沉淀未见溶解,则该白色沉淀的成分是______(填化学式),则产生该白色沉淀的离子方程式是__ _ ___。
配制一定物质的量浓度的溶液是实验室进行科学研究的重要环节。
(1)若配制大约1 mol·L-1叫的溶液100 mL,所给仪器只有托盘天平、量筒、带刻度的烧杯、玻璃棒,下列可选用的试剂是(填字母序号)。
| A.氢氧化钠固体 | B.浓硫酸(98%) | C.浓盐酸(37%) | D.浓硝酸(63%) |
(2)下图是某学生在配制0.100 mol·L-1的碳酸钠溶液100 mL时,将第一次洗涤液转移到容量瓶内的操作。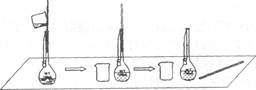
该步操作对所得溶液浓度的影响是(填“偏高”、“偏低”或“无影响”),原因是
.
(3)若配制(2)中溶液时,该生使用托盘天平称取碳酸钠,则与计算量一致吗?为什么?
.
(4)现用移液管准确量取20.0 mI。0.100 mol·L-1盼碳酸钠溶液,注入锥形瓶中滴加甲基橙试剂2~3滴,此时溶液呈色。然后将待测稀盐酸注入洁净、干燥的滴定管内,记下滴定管内稀盐酸的初始刻度读数,接着开始向锥形瓶内滴加盐酸。当锥形瓶内溶液颜色突变成色时即达到滴定终点,此时消耗盐酸体积为21.36 mI。,则待测盐酸的浓度为mol·L-1。
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用一个月才充电一次.假定放电过程中,甲醇完全氧化产生二氧化碳被充分吸收生成CO32-.
(1)该电池反应的离子方程式为
(2)甲醇在极发生反应(填“正”或“负”),电池中放电过程中溶液pH将(填“下降”、“上升”或“不变”);若有16克甲醇蒸汽被完全氧化产生电能,并利用该过程中释放的电能电解足量的硫酸铜溶液假设能量利用率为80%。则将产生标准状况下氧气L。
(3)最近,又有科学家制造出一种固体电解质的燃料电池,其效率更高。一个电极通入空气,另一个电极通入汽油蒸汽。其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导O2-离子(其中氧化反应发生完全)。以丁烷代表汽油。该电池的正极反应式为;
(4)放电时固体电解质里的O2-离子的移动方向是向 极移动(填“正”或“负”)。
Al-Mg在不同的电解质溶液中分别构成原电池A、B。如下图所示: 
指出各池中的负极材料并写出其电极方程式。
①负极材料:
A池,B池。
②电极反应式:
A池:正极,负极。
B池:正极,负极。
③从构成原电池的几个组成部分来看,判断原电池的负极,除了要考虑金属的活泼性外,还要考虑