某人工合成香料H,其合成路线可简单表示如下: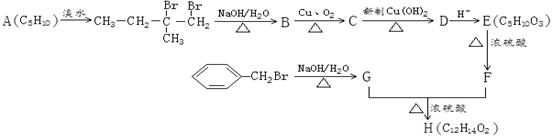
已知:F的分子结构中含有2个甲基。
请回答下列问题:
A的名称(系统命名)是 ;C中官能团的名称为 。
E→F的反应类型是 ;H的结构简式是 。
C→D的化学方程式是 ;
E在一定条件下生成的高分子化合物的结构简式为 。
X是F的同分异构体,它同时符合下列3个条件,则X可能的结构简式为 、 (写出任意两种)。
①能发生水解反应 ②不含甲基 ③能发生银镜反应
(10分)某课外研究性学习小组拟用粗盐(含有少量杂质包括:泥沙、CaCl2、MgCl2、Na2SO4)经提纯后,配制0.4mol/L 450mL NaCl溶液。他们设计并实施了如下实验,请根据已学过的知识回答下列问题:
(1)取一定量的粗盐置于烧杯中加水溶解,所加的水量应为:。(填选项)
A.多加水配成较稀的溶液。
B.加入适量的水至能溶解的固体溶解即止。
(2)将(1)中配制的粗盐悬浊液过滤后取滤液加入过量的除杂试剂,如果除杂试剂可从下列六种溶液中选择①Na2CO3溶液②KOH溶液③AgNO3溶液④NaOH溶液⑤NaHCO3溶液⑥BaCl2溶液,则正确的试剂和加入的顺序应为:。(填选项,多选、少选、错选都不得分)
A.①②③
B.②⑥⑤
C.④⑥①
D.①④⑥
E.⑥①④
F.⑥②⑤
将所得的悬浊液经过滤后取滤液加入足量的盐酸,充分反应后对混合溶液进行蒸发、过滤、洗涤、干燥操作,得到纯净的NaCl固体。
(3)利用(2)中所得的NaCl固体继续配制所需溶液。在托盘天平上称量g NaCl固体。配制过程中需要使用的玻璃仪器有:烧杯、玻璃棒、和。
(4)配制结束后同学们对实验中出现的某些错误操作,对最终配制的溶液浓度的影响进行了分析,则下列错误操作会导致最终配制溶液中NaCl的浓度相比0.4mol/L的偏差是:(填 “偏大”、“偏小”、“无影响”)
①在上述(2)步中没有使用盐酸处理滤液,结果会。
②定容时俯视凹液面,结果会。
③上下颠倒摇匀后液面低于刻度线,未及时加水至刻度线,结果会。
(10分)如图中A~H均为中学化学中常见的物质,A、B、H是气体,其中A为黄绿色气体,它们之间有如下转化关系.(反应中生成的水已略去)
请回答以下问题:
(1)E是,F是,H是;(填化学式)
(2)C物质在日常生活中可作剂。
(3)写出反应①的化学方程式:。
(12分)氧化还原反应广泛地存在于生产和生活之中,如对水的杀菌消毒、食物变质和防腐、金属冶炼、钢铁的锈蚀等等。这说明氧化还原反应在实际应用中也具有正、负两方面的影响,我们就是要掌握其变化规律,从而做到趋利避害。
(1)氯气跟水反应生成的次氯酸(HClO)具有杀菌作用,常用于自来水的消毒,在次氯酸(HClO)中,氯元素的化合价为 ,氯原子容易得到电子,从而使氯元素化合价降低,因此次氯酸具有强 。写出氯气与水反应的化学方程式,并用双线桥法标出电子转移的方向和数目。
(2)苹果汁是人们喜爱的饮料,由于此饮料中含有Fe2+。现榨的苹果汁在空气中会由淡绿色(Fe2+)变为棕黄色(Fe3+)。若榨汁时加入维生素C,可有效防止这种现象发生。
以上现象说明维生素C具有性。
(3)自然界中存在的元素大多以化合态存在,而我们在生产和生活中需要许多单质如金属镁、单质溴等。把某元素由化合态变成游离态,则它()
A.被氧化B.被还原
C.有可能被氧化,也可能被还原D.由高价态变成零价
(4)糕点等食品包装内封入一个类似干燥剂的小袋—脱氧剂。其作用是吸收氧气,使食品因缺氧而不变质、发霉等,从而可长期保存食品。铁脱氧剂就是利用铁易被氧化的性质来吸收氧气,最终产物是Fe2O3·3H2O。有关的反应如下:①2Fe+O2+2H2O=2Fe(OH)2;
②4 Fe(OH)2+O2+2H2O="4" Fe(OH)3;③2 Fe(OH)3=Fe2O3·3H2O。
关于这个过程中说法正确的是()
A.整个过程中只有Fe作还原剂、O2作氧化剂
B.①②反应既是化合反应又是氧化还原反应
C.③反应中Fe(OH)3既是氧化剂又是还原剂
D.该脱氧化剂在没有水分作用下也能脱氧
(1)根据分子中所含官能团可预测有机化合物的性质。
①下列化合物中能发生消去反应的是__________(填字母)。
a.CH3OH b.CH3CH2Clc.CH3CH2OH d.
②下列化合物中,常温下易被空气氧化的是_________(填字母)。
a.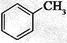 b.
b. c.
c. d.
d.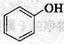
(2)甲苯( )是一种重要的有机化工原料。
)是一种重要的有机化工原料。
①甲苯分子中一定共平面的碳原子有_______个。
②甲苯苯环上的一溴代物有______种,请写出其中一种的结构简式__________。
③除去苯中混有的少量甲苯,可选用的试剂是_____________。
(3)化合物C是一种医药中间体,可通过下列方法合成: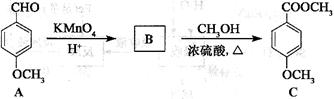
已知: 。
。
①A中含氧官能团的名称为_________和_________。
②B的结构简式为______________。
③B→C的反应类型为__________。
④C的同分异构体D能发生银镜反应,能与FeCl3溶液发生显色反应,且1molD最多能与2molNaOH反应。D分子核磁共振氢谱(1HNMR)中有4种不同信号峰,请写出D的一种结构简式:______________。
(共12分)某芳香烃衍生物的分子式为C7H8O,根据下列实验现象,确定结构简式。
(1)若该有机物遇FeCl3溶液显色,则其可能的结构简式为:
,,。
上述的三种物质中,苯环上的一氯代物种类最少的一氯代烃有种,最多的一氯代烃有种。
(2)若该有机物不能与金属钠反应产生氢气,则结构中会有(填官能团)出现。