V、W、X、Y、Z是五种常见元素,其中V、W、X、Y四种短周期元素在周期表中的位置如下图所示:V、W的最简单气态氢化物M、N混合时有白烟生成,M能使湿润的pH试纸变蓝。Z是人体血红蛋白中存在的金属元素。请填写下列空白:
(1)W的原子结构示意图为 ;
(2)二氧化钛(TiO2)与X的单质、Y的单质高温下反应生成两种化合物,这两种化合物均由两种元素组成。其反应的化学方程式为 ;
(3)含X元素的一种化合物A与Y的最高价氧化物C之间有如下的反应关系: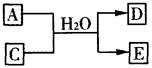
若E为白色沉淀,则E物质的化学式为 ;
(4)常温下,相同浓度 X、Z简单离子的溶液中滴加NaOH溶液,X、Z两元素先后沉淀,X(OH)n完全沉淀的pH是4.7,Z(OH)n完全沉淀的pH是2.8,则Ksp[X(OH)n] (填“>”或 “<”) Ksp[Z(OH)n];
(5)Y与氢能形成多种化合物,其中一种为Y2H2。2.00g Y2H2完全燃烧生成液态水和二氧化碳,放出99.6kJ热量,写出Y2H2燃烧的热化学反应方程式________________________________________________________;
(6)同温同压下,将a L M气体和b LN气体通入水中,若所得溶液的pH=7,则a b(填“>"或“<”或“=”)。
乙炔是有机合成工业的一种重要原料。工业上曾用CaC2与水反应生成乙炔。
(1)CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为,1mol O22+中含有的π键数目为。
(2)将乙炔通入[Cu(NH3)2]Cl溶液中生成红棕色沉淀Cu2C2。Cu+简写的核外电子排布式为。
(3)乙炔与HCN反应可得到丙烯腈(CH2=CH—C≡N), 丙烯腈分子中碳原子轨道的杂化类型是;分子中处于同一直线上原子数目最多有个。
(4)CaC2晶体的晶胞结构与NaCl晶体相似(如图所示),但CaC2晶体中哑铃形的C22-的存在,使晶胞沿一个方向拉长, CaC2晶体中一个Ca2+周围距离最近的C22-数目为。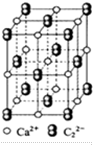
某实验小组的同学对电化学原理进行了一系列探究活动
(1)如图为某实验小组依据氧化还原反应:(用离子方程式表示)设计的原电池装置,反应前,两电极质量相等,一段时间后,两电极质量相差18g,则导线中通过mol电子。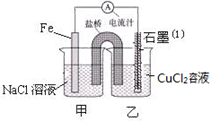
(2)用胶头滴管吸出铁片附近溶液少许置于试管中,向其中滴加少量新制饱和氯水,写出发生反应的离子方程式,然后滴加几滴硫氰化钾溶液,溶液变红;继续滴加过量新制饱和氯水,红色褪去,假设之一是“溶液中的+3价铁被氧化为更高的价态”。如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式。
(3)如图其它条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示,石墨(1)为极(填“正”、“负”、“阴”或 “阳”)。在甲装置中滴加几滴酚酞试液,振荡均匀,一段时间后,在甲装置中观察到电极(填“铁”或“铜”)附近溶液先变红,该电极的反应式为。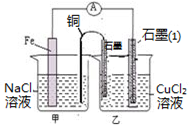
按要求回答下列问题:
(1)常温下,向VL 0.1mol/L的醋酸溶液中加水稀释,下列说法中正确的是(填字母)
A.溶液中导电粒子的数目将减少
B.由水电离的c(H+)浓度将减小
C.溶液中不变
D.溶液中 将减小
将减小
E.醋酸的电离程度将增大,c(H+)也增大
(2)①常温下,将0.1mol/L的硫酸V1mL与0.1mol/LNaOH溶液V2mL混合后,溶液的pH=1则V1:V2=(忽略溶液体积的变化)。
②常温下,若溶液由pH=3的盐酸V1mL与pH=11的某碱BOH溶液V2mL混合而得,则下列假设和结论都正确的是(填字母)
A.若混合后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol/L
B.若V1=V2,则混合后溶液的pH一定等于7
C.若V1=V2,则混合后一定有:c(Cl-)>c(B+)>c(H+)>c(OH-)
D.混合后的溶液中一定有c(B+)+c(H+)=c(Cl-)+c(OH-)
(3)常温下,浓度均为0.1mol/L的五种溶液的pH如下表所示:
| 溶液 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
①写出向NaClO溶液中通入少量CO2的离子方程式。
②将浓度均为0.01mol/L下列溶液分别加水稀释10倍,pH变化最小的是(填字母)
A.HCNB.HClO C.H2CO3D.CH3COOH
③常温下,等浓度的醋酸与醋酸钠组成的混合溶液pH=6,则c(CH3COO-)-c(CH3COOH)=(填准确数值)。
(4)已知常温下Ksp(AgCl)=1.0×10-10,Ksp (CH3COOAg)=9.0×10-4。常温下,CH3COOAg若要在NaCl溶液中开始转化为AgCl沉淀,则NaCl的浓度必须不低于。
(1)已知反应Ⅰ:4NH3(g)+3O2(g)==2N2(g)+6H2O(g)△H=-1266.8kJ/mol
反应Ⅱ:N2(g) + O2(g)="=" 2NO(g) △=+180.5kJ/mol
它们的平衡常数依次为K1、K2
①写出氨高温催化氧化生成NO的热化学方程式,该反应的化学平衡常数的表达式K=(用含K1、K2的代数式表示)。
②反应Ⅰ可设计成燃料电池,若该电池以KOH溶液作电解质溶液,则负极的电极反应式为:。该电池使用过程中,正极附近溶液的pH将(填“升高”、“降低”或“不变”)。
(2)已知:N2(g) +3H2(g)  2NH3(g) △H=-92kJ/mol。
2NH3(g) △H=-92kJ/mol。
①为提高H2的转化率,宜采取的措施有(填字母)
| A.及时移出氨 | B.升高温度 |
| C.使用催化剂 | D.循环利用和不断补充N2 |
②在一定温度、压强下,将N2和H2按体积比1:3在密闭容器中混合,当反应达平衡时,测得平衡混合气体中NH3的体积分数为25%,此时H2的转化率为。
有机物键线式结构的特点是以线示键,每个折点和线端处表示有一个碳原子,并以氢补足四键,C、H不表示出来,其它原子或原子团要表示出来,例如:CH3CHOHCH3的键线式结构为 。CH3CH=CHCH3是石油裂解的产物之一,它的键线式结构可表示为
。CH3CH=CHCH3是石油裂解的产物之一,它的键线式结构可表示为 。
。
(1)CH3CH=CHCH3的名称为,其所含官能团的结构式为,与H2在一定条件下发生加成反应,其产物的同分异构体的键线式结构为。
(2)完成下列反应方程式,产物用键线式表示: +Br2→,反应类型为反应。
+Br2→,反应类型为反应。
(3) 是一种加聚产物,则其单体的结构简式为,其链节为。
是一种加聚产物,则其单体的结构简式为,其链节为。
(4)写出与CH3CH=CHCH3含有相同官能团的同分异构体的结构简式。(任写一种)