已知: NO3-+4H++3e-→NO+2H2O 。现有四种物质:KMnO4、Na2CO3、Cu2O、Fe2(SO4)3,其中能使上述还原过程发生的是 (填化学式),写出该反应化学方程式中氧化产物的化学计量数(写方框内)及其化学式□ 。1mol该物质与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是: 。
某待测液中可能含有Ag+、Fe3+、K+、Ba2+、NH4+等离子,进行如下实验:
①向该待测液中加入过量的稀盐酸,有白色沉淀生成。
②过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成。
③过滤,取少量滤液,滴入2滴KSCN溶液,没有明显的现象出现。
④另取少量步骤③中的滤液,加入NaOH溶液至溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体。
根据实验现象回答:
(1)待测液中一定含有离子,一定不含有离子。
(2)还有一种离子无法确定是否存在,检验该离子实验方法的名称是观察到的现象是 。
置换反应的通式可表示为: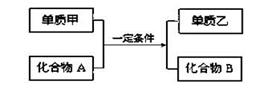
单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:
(1)若A为两种元素形成常温下呈液态的化合物,化合物B的焰色反应呈黄色,则该反应的化学方程式为:。
(2)若甲是一种金属单质,在高温条件下,本反应常用于焊接钢轨。则该反应的化学方程式为:。
(3)若单质乙是黑色非金属固体单质,化合物B是一种白色金属氧化物,则该反应的化学方程式为:。
Ⅰ将适量的蔗糖放入烧杯中,加入少量水,搅拌均匀。然后加入适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体。
(1)生成的黑色物质是(填化学式)。
(2)“体积膨胀,并放出有刺激性气味的气体”,写出对应的化学方程式。
(3)在(2)的反应中,体现浓硫酸具有 (填序号)。
①酸性②吸水性③脱水性④强氧化性
Ⅱ向80mL浓硫酸中加入56g铜片,加热,至不再反应为止。
(1)写出铜与浓硫酸反应的化学方程式。
(2)实验测得反应中共有13.44L SO2(标准状况)生成,反应中转移的电子有mol。
围绕下列七种物质:①铝、②A12O3、③稀硝酸、④H2SO4、⑤Ba(OH)2固体、⑥稀氨水、⑦A12(SO4)3,根据要求回答下列问题。
(1)既能与强酸反应,又能与强碱反应的是 (填序号)。
(2)属于电解质的是(填序号)。
(3)写出最适宜制取Al(OH)3的离子方程式: 。
(4)两物质间发生反应的离子方程式为H++OH-= H2O,请写出该反应的化学方程式:。
(5)34.2g⑦溶于水配成500mL溶液,则溶液中SO42-的物质的量浓度为 。
高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g) Fe(s)+CO2(g) ΔH>0
Fe(s)+CO2(g) ΔH>0
(1)则该反应中平衡常数表达式为K=。温度升高,化学平衡移动后达到新的平衡,K值(填“增大”,“减小”或“不变”)。
(2)已知1100℃时K=0.263,1100℃时向高炉中充入一定量的FeO固体和CO气体,某时刻测得高炉中c(CO2)=0.025mol·L-1,c(CO)=0.1mol·L-1,此时CO气体的转化率为(用百分数表示),此时该反应是否处于平衡状态(填“是”或“否”)。