有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素.已知A、C及B、E分别是同主族元素,且B、E两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍.处于同周期的C、D、E元素中,D是该周期金属元素中金属性最弱的元素.
(1)试比较C、D两元素最高价氧化物对应水化物碱性的强弱(填化学式)
> ;
(2)A、B、C形成的化合物的晶体类型为 ;电子式为 ;
(3)写出D单质与C元素最高价氧化物对应水化物反应的离子方程式 ;
(4)写出两种均含A、B、C、E四种元素的化合物在溶液中相互反应、且生成气体的离子方程式 ;
(5)A单质和B单质能构成电池,该电池用多孔惰性电极浸入浓KOH溶液,两极分别通入A单质和B单质,写出该电池负极电极反应方程式 ;
(6)通常条件下, C的最高价氧化物对应水化物2mol与E最高价氧化物对应水化物1mol的稀溶液间反应放出的热量为114.6KJ,试写出表示该热量变化的离子方程式 .
25时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因(用离子方程式表示):
___________________________________________________________________;
(2)混合溶液中由水电离出的c(H+)_____(填“<”“>”“=”)0.1 mol·L-1 NaOH溶液中由水电离出的c(H+);
(3)求出混合液中下列算式的精确计算结果:
c (Na+)-c (A-)=______________mol·L-1;
(4)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH_____7 (填“<”“>”“=”);
(5)将相同温度下相同浓度的五种溶液:
①(NH4)2CO3②NH3·H2O③(NH4)2SO4④NH4Cl⑤CH3COONH4
按c(NH4+)由大到小的顺序排列___________________(填序号)。
已知:A酸的溶液pH=a,B碱的溶液pH="b"
(1)若A为盐酸,B为氢氧化钠,且a+b=14,二者等体积混合,则溶液的pH=。若酸碱按体积比为1:10混合后溶液显中性,
则a+b=。
(2)若A为醋酸,B为氢氧化钡,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为mol·L-1,B溶液中水电离出的氢离子浓度为。mol·L-1
(3)若A为醋酸,B为氢氧化钠,且a+b=14,将体积为VA的醋酸和体积为VB的氢氧化钠溶液混合后,溶液显中性,则其体积关系VA VB,
混合后溶液中的离子浓度关系为c(Na+) c(CH3COO-)
(填“<”“>”或“=”)。
(4)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,
其水解反应的离子方程式为。
某无色透明溶液中可能大量存在Ag+、Mg2+、Fe3+中的几种离子。
(1)不做任何实验就可以肯定原溶液中不存在的离子是。
(2)取少量原溶液加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,说明原溶液中肯定有的离子,有关的离子反应式为。
(3)取(2)的滤液加入过量NaOH溶液,出现白色沉淀,说明原溶液中肯定存在的离子有。
(4)原溶液中可能大量存在的阴离子是下列A~D中的(填序号)。
| A.Cl- | B.NO3- | C.CO32- | D.OH- |
下列为一些常见物质的相互转化关系图。已知:A是生活生产中常用的一种金属单质,B为淡黄色粉末,C在常温下为无色液体,H为白色沉淀,J为红褐色沉淀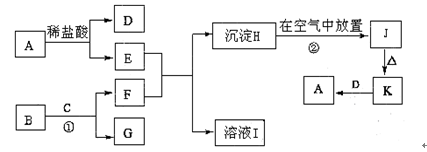
请写出:
(1) A、B的化学式为:A,B。
(2)过程②中的反应现象:。
(3)反应①的化学方程式。
已知铜在常温下能被浓HNO3溶解,反应为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
(1)请将上述反应改写成离子方程式。
(2)NO2是一种色的气体,在上述反应中作(填“氧化”或“还原”)产物,而且是一种能与水反应的气体,其反应的化学方程式为。
(3)上述反应中氧化剂与还原剂的物质的量之比为,HNO3在反应中表现出性和性。
(4)若反应中生成1mol的NO2,则反应中转移mol的电子,消耗Cug。