碳酸镁晶须是一种新型的吸波隐形材料中的增强材料。
(1)合成该物质的步骤如下:
步骤1:配制0.5mol·L-1MgSO4溶液和0.5mol·L-1NH4HCO3溶液。
步骤2:用量筒量取500mL NH4HCO3溶液于1000mL四口烧瓶中,开启搅拌器。温度控制在50℃。
步骤3:将250mL MgSO4溶液逐滴加入NH4HCO3溶液中,1min内滴加完后,用氨水调节溶液pH到9.5。
步骤4:放置1h后,过滤,洗涤。
步骤5:在40℃的真空干燥箱中干燥10h,得碳酸镁晶须产品(MgCO3·nH2O n=1~5)。
①步骤2控制温度在50℃,较好的加热方法是 。
②步骤3生成MgCO3·nH2O沉淀的离子方程式为 。
③步骤4检验是否洗涤干净的方法是 。
(2)测定合成的MgCO3·nH2O中的n值。
称量1.000g碳酸镁晶须,放入如图所示的广口瓶中加入水滴入稀硫酸与晶须反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5h,反应后期将温度升到30℃,最后的烧杯中的溶液用已知浓度的盐酸滴定,测得CO2的总量;重复上述操作2次。
①图中气球的作用是 。
②上述反应后期要升温到30℃,主要目的是 。
③设3次实验测得每1.000g碳酸镁晶须产生的CO2平均值为a mol,则n值为 (用含a的表达式表示)。
(3)称取100g上述晶须产品进行热重分析,热重曲线如图。
则该条件下合成的晶须中,n= (选填:1、2、3、4、5)。
某校某班化学兴趣小组进行了下列两项试验活动:(1)探究草酸(H2C2O4)与高锰酸钾溶液在不同条件下反应的快慢;(2)测定草酸晶体的纯度。已知:①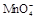 在酸性环境下的还原产物是
在酸性环境下的还原产物是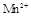 ;②草酸是二元弱酸。
;②草酸是二元弱酸。
Ⅰ.探究草酸与高锰酸钾溶液在不同条件下反应的快慢
取4支试管,分别加入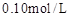 的草酸溶液
的草酸溶液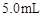 ,按下表中四种方案分别加入相应的试剂,使其发生反应。四支试管中均可观察到有气泡产生,且溶液的颜色变化都为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如下表所示(表中“—”表示未加入该试剂)。
,按下表中四种方案分别加入相应的试剂,使其发生反应。四支试管中均可观察到有气泡产生,且溶液的颜色变化都为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如下表所示(表中“—”表示未加入该试剂)。
| 实验 编号 |
反应温度 (利用水浴加热) |
稀硫酸溶液 |
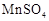 固体 固体 |
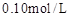 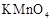 溶液 溶液 |
褪色时间 |
| 1 |
65℃ |
— |
— |
1.0mL |
100s |
| 2 |
65℃ |
10滴 |
— |
1.0mL |
90s |
| 3 |
75℃ |
10滴 |
— |
1.0mL |
40s |
| 4 |
75℃ |
10滴 |
加入少许 |
1.0mL |
3s |
根据以上4组实验,可以得出的结论主要有_______________________________。
Ⅱ.测定草酸晶体的纯度
用托盘天平称取草酸晶体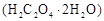 样品
样品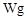 ;配制成
;配制成 溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定;滴定实验重复操作2—3次。请回答:
溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定;滴定实验重复操作2—3次。请回答:
(1)实验中需要用到的玻璃仪器除了玻璃棒、烧杯、锥形瓶、胶头滴管、250mL容量瓶外还需要的一种玻璃仪器是____________。(填仪器名称)
(2)上述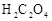 溶液与酸性
溶液与酸性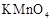 溶液反应的离子方程式为_________。
溶液反应的离子方程式为_________。
(3)若滴定过程中平均消耗酸性高锰酸钾溶液VmL,则草酸晶体的纯度为_______(以含W、V的表达式表示)。
(13分)某校化学兴趣小组为探究铁与浓硫酸的反应,设计了图1、图2所示装置进行实验。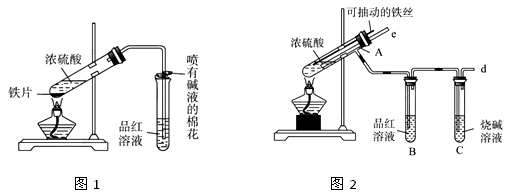
(1)比较两个实验装置,图2装置的优点是:
①能更好的吸收有毒气体SO2防止其污染环境;
②。
(2)导气管e有两个主要作用:一是在反应过程中,因导管插入液面下,可起到”液封”作用阻止SO2气体逸出而防止污染环境;二是。
(3)能说明有SO2气体产生的实验现象是。
(4)反应一段时间后,用滴管吸取A试管中的溶液滴入到适量水中作为试样,试样中所含金属离子的成分有以下三种可能:
Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ:既有Fe3+又有Fe2+。
为验证Ⅱ、Ⅲ的可能性,选用如下试剂,填写下列空格:
| A.稀HCl溶液 | B.稀硫酸 | C.KSCN溶液 | D.酸性KMnO4溶液 |
E.NaOH溶液 F.淀粉KI溶液 G. H2O2溶液
验证Ⅱ:取试样,先滴加少量的(填试剂序号,下同),振荡,再滴加少量的,根据溶液颜色的变化可确定假设Ⅱ是否正确。
验证Ⅲ:步骤1.取试样,滴加少量的(填试剂序号),溶液的颜色变色,则试样中含有Fe3+发生反应的离子方程式为。
步骤2.再取适量的试样滴加少量的(填试剂序号),溶液颜色的变化为,则试样中含有Fe2+。
(12分)某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质。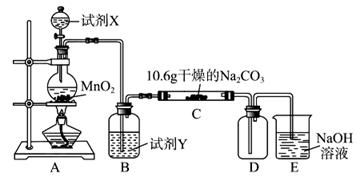
(1)写出装置A中发生反应的化学方程式:。
(2)写出试剂Y的名称:。
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物。可以确定的是C中含有的氯盐只有一种,且含有NaHCO3,现对C成分进行猜想和探究。
①提出合理假设。
假设一:存在两种成分: NaHCO3和;
假设二:存在三种成分: NaHCO3和、。
②设计方案,进行实验。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
| 实验步骤 |
预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中。 |
|
| 步骤2: |
|
| 步骤3: |
(4)已知C中有0.1 mol Cl2参加反应。若假设一成立,可推知C中反应的化学方程式为。
空气中的SO2含量和可吸入颗粒的含量(可用g/cm3表示)都是重要的空气质量指标。在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得超过0.02 mg/L。
(1)为测定某地方的空气中SO2和可吸入颗粒的含量,甲同学设计了如下图所示的实验装置: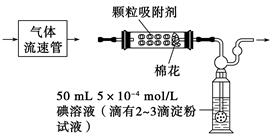
注:气体流速管是用来测量单位时间内通过气体的体积的装置
①应用上述装置测定空气中的SO2含量和可吸入颗粒的含量,除测定气体流速(单位:cm3/min)外,还需要测定___________________________________________________
②已知:碘单质微溶于水,KI可以增大碘在水中的溶解度。
请你协助甲同学完成100 mL 5×10-4 mol/L碘溶液的配制:
第一步:准确称取1.27g碘单质加入烧杯中,___________________________
第二步:___________________________________________________________;
第三步:从第二步所得溶液中,取出10.00 mL溶液于100 mL容量瓶中,加水稀释至刻度线。
(2)乙同学拟用如图所示简易装置测定空气中的SO2含量:准确移取50 mL 5×10-4 mol/L的碘溶液,注入图中所示广口瓶中,加2~3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100 mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。
①假设乙同学的测量是准确的,乙同学抽气的次数至少为________次,方可说明该地空气中的SO2含量符合排放标准。
②如果乙同学用该方法测量空气中SO2的含量时,所测得的数值比实际含量低,请你对其可能的原因(假设溶液配制、称量或量取及各种读数均无错误)提出两种合理假设:__________________、______________________。
③丙同学认为:乙同学的实验方案需要抽气的次数太多,操作麻烦。与乙讨论后,决定将抽气次数降到100次以下,请你设计合理的改进方案:_________________________。
SO2是大气污染物之一,为粗略地测定周围环境中SO2的含量,某学生课外活动小组设计了如下图所示实验装置。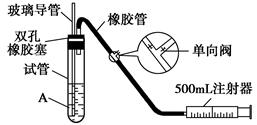
(1).检查该装置的气密性时,先在试管中装入适量的水(保证玻璃导管的下端浸没在水中),然后_______________________________________(填写操作方法)时,将会看到________________(填写实验现象),则证明该装置的气密性良好( )
A.向外轻轻拉动注射器的活塞 浸没在水中的玻璃导管口有气泡冒出
B.向内轻轻推动注射器的活塞 浸没在水中的玻璃导管口有气泡冒出
C.向外轻轻拉动注射器的活塞 浸没在水中的玻璃导管口有水柱上升
D.手握试管 浸没在水中的玻璃导管口有气泡冒出
(2).向试管中加入0.000 5 mol/L碘水1.0 mL,用适量的蒸馏水稀释后再加入2~3滴淀粉溶液,配制成溶液A。测定指定地点的空气中SO2的含量时,推拉注射器的活塞反复抽气,A溶液由________色变成______色时反应恰好完全进行,此时停止抽气( )
A.红 无 B.无 红 C.蓝 无 D.无 蓝
(3).我国环境空气质量标准中对每次空气质量测定中SO2的最高浓度限值如下表:
| 浓度限值/mg/m3 |
||
| 一级标准 |
二极标准 |
三级标准 |
| 0.15 |
0.50 |
0.70 |
该学生课外活动小组分成第一小组和第二小组,使用相同的实验装置和溶液A。在同一地点、同时测量空气中SO2的含量。反应恰好完全进行,记录抽气次数和结果如下(假设每次抽气500 mL)。
| 分组 |
第一小组 |
第二小组 |
| 抽气次数 |
100 |
120 |
| SO2含量/mg/m3 |
0.64 |
0.53 |
____小组的测定结果正确( )
A.第一 B.第二
C.都正确 D.都不正确
(4).判断该地点的空气中SO2的含量属于________标准( )
A.一级 B.二级 C.三级 D.四级
(5).实验结果产生较大偏差的原因是(所用装置和药品均无问题)( )
A.抽气速度过快,造成空气中SO2无法与碘水充分反应,产生较大的误差
B.抽气速度过慢,造成空气中SO2无法与碘水充分反应,产生较大的误差
C.装置漏气,造成空气中SO2无法与碘水充分反应,产生较大的误差
D.抽气速度过快,造成空气中O2与碘水充分反应,产生较大的误差