实验课上,小舟同学向盛有澄清石灰水的烧杯中加入过量的碳酸钠溶液,生成白色沉淀,过滤后得到无色溶液,他说:“我制得了氢氧化钠溶液!”
(1)小帆同学却说:“这种无色溶液中不一定含有氢氧化钠”他做了如下实验:
| 实验步骤 |
实验现象 |
实验结论 |
| 用试管取无色溶液少许,滴入2滴无色酚酞试液 |
无色酚酞试液变红 |
无色溶液中含有氢氧化钠 |
小玉认为小帆的实验方案也不严密,不能证实无色溶液中一定含有氢氧化钠,理由是: 。
(2)小玉设计了另一个实验:
| 实验步骤 |
实验现象 |
实验结论 |
| ①取少量样品于试管中,加入 ②过滤,向滤液中滴加几滴硫酸铜溶液 |
③ ④ |
无色溶液中确实含有氢氧化钠 |
(3)小玉的实验可靠性高的原因是① 、② 。
草木灰是农家肥料,主要含钾盐。请回答相关问题。
【分离提纯】
(1)在烧杯里放一定量的草木灰,加入水,同时用玻璃棒搅拌。浸出溶液中主要含有的金属阳离子是。
(2)把烧杯中的草木灰连同浸出液一起过滤。如果滤液仍然浑浊,处理的方法是。
(3)把滤液倒入蒸发皿里,加热,用玻璃棒搅拌。当蒸发到时,停止加热。
【成分探究】
取(3)所得的晶体少量溶于水,分到两支试管中。
(4)第一支:滴加盐酸,产生能使澄清的石灰水变浑浊的气体。请写出化学方程式:
①加盐酸:;
②产生浑浊:。
(5)第二支:滴加酚酞溶液后,溶液变为色,说明溶液呈碱性。为证明溶液呈碱性是由
引起的,再向试管中加入〔可供选择试剂:澄清石灰水、
溶液(呈中性)、
溶液(呈中性)〕,此时发生反应的方程式为,当看到时即可证明。因此,草木灰(填"能"或"不能")与铵态氮肥混合施用。
将0.4%的氢氧化钠溶液滴加到2
0.4%的盐酸中,测得混合液的
变化曲线如图。某学习小组对加入0-
氢氧化钠过程中,所得混合液
增大原因进行了如下探究: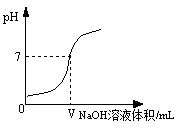
【猜想假设】
猜想Ⅰ:
增大是因为;
猜想Ⅱ:
增大是因为发生了反应,写出反应方程式。
【实验探究】
为验证猜想Ⅱ,请你帮助该小组完成下列实验。(可供选择的实验用品有:
计、0.4%的氢氧化钠溶液、0.4%的盐酸、水。)
(1)向2
0.4%的盐酸中加入
0.4%的氢氧化钠溶液,用pH计测得混合液的
=7。
(2)向2
0.4%的盐酸中加入
,用pH计测得混合液的
7(填">"、"="或"<")。综合(1)和(2)证明猜想Ⅱ成立。
善于提出问题、探究问题和解决问题是学好化学的重要方法。某研究性学习小组的同学在学习铁及其化合物知识时进行了系列研究。
I.提出问题
问题1:铁为何称为黑色金属?
问题2:铁和氧气在不同条件下能发生哪些反应?
问题3:铁有多种氧化物,它们的性质有哪些差异?
问题4:钢铁厂在选矿时,如何测定铁矿石中的含铁量?
问题5:用一氧化碳还原氧化铁得到的黑色固体一定是单质铁吗?
II.解决问题
【问题1】上网查寻,有两种说法:
a.因为在铁表面有黑色的铁的氧化物,所以叫黑色金属。
b.因为铁的粉末为黑色,铁的氧化物也均为黑色,所以叫黑色金属。
(1)你认为正确的说法是(填"a"或"b")。
【问题2】通过学习,已经知道铁丝在潮湿的空气中能生锈,也能在纯氧中燃烧。
(2)请写出一种防止钢铁生锈的方法。
(3)请写出铁丝在纯氧中燃烧的化学方程式。
【问题3】查阅资料:
a.铁常见的氧化物有氧化铁(
)、四氧化三铁(
)和氧化亚铁
)。
b.四氧化三铁是具有磁性的黑色晶体,可以近似地看作是氧化亚铁和氧化铁的化合物,它不溶于水,能与酸反应生成两种盐。
c.氧化亚铁是不溶于水的黑色粉末,能与酸反应,无磁性,也不能被磁铁吸引。
(4)请写出四氧化三铁与盐酸反应的化学方程式。
(5)有一包黑色粉末;可能是铁粉、
粉末、
粉末中的一种,请你设计一种实验方案进行鉴别。
【问题4】同学们参观了某钢铁厂,了解到钢铁厂在选矿时测定铁矿石中含铁量的方法较多。小明结合所学知识,设计了如图所示的实验装置测定某赤铁矿样品中
的质量分数。他称取l0.0g赤铁矿,当赤钛矿中的
全部还原为
时,剩余固体在
的保护下冷却、称量,质量为7.6g(假设赤铁矿中的杂质均不与
反应)。

(6)图中酒精灯的作用是。
(7)该赤铁矿中
的质量分数为(列出计算过程)。
【问题5]在钢铁厂的实验室,同学们采集了用某种热分析仪记录的
与
进行反应时的有关数据,并得到固体质量与反应温度的关系曲线,如图所示:
(8)根据图像分析,写出P点时固体成分的化学式,固体质量由48.0g变为46.4g的过程中发生反应的化学方程式为。
课外小科约老师继续探究铁粉和硫粉反应的实验:他们各自取一定量的铁粉和硫粉均匀混合后堆放在石棉网上,在其中插入烧红的玻璃棒,反应立即发生。拿掉玻璃棒后,反应继续剧烈进行,反应过程中有少量刺激性气味的气体x产生。反应结束后,都得到了黑色固体。老师得到的黑色固体不会被磁铁吸引,而小科的却会被磁铁吸引。
(1)铁和硫的反应是(填"放热"或"吸热")反应。
(2)气体
的化学式为。
(3)对比老师的实验结果,小科猜想自己得到的黑色固体可能是有剩余的铁或有生成的四氧化三铁。小科想验证是否有铁剩余。
老师启发小科:硫化亚铁能与稀硫酸反应,产生硫化氢气体,该气体能被氢氧化钠溶液吸收。于是,小科认为正确连接如图所示的三个装置并进行实验,如果
处有水压出,就能验证有铁剩余。
①小科依次连接各装置的导管口:
。(填"
"或"
")
②老师指出设计不够合理,不能就此验正猜想。请你帮小科说出不够合理的原因:。
于是小科改进了实验设计,继续进行探究…
实验室中常用分解过氧化氢来简便快速的制备氧气,化学小组进一步探究外界条件对过氧化氢分解速率的影响,并进行了氧气的性质实验。
[查阅资料]有些水果、蔬菜对过氧化氢的分解有催化作用。
[实验探究1]探究苹果和土豆对过氧化氢分解是否有催化作用及催化效果:
各量取6ml的过氧化氢溶液,分别倒入1、2、3号三志试管中,取大小、形状基本相同的苹果块和土豆块,分别放入2、3号试管中,并把带火星的木条分别同时伸入三支试管口内,观察现象并记录如下:
| 试管编号 |
1 |
2 |
3 |
|
| 材料名称 |
无 |
苹果 |
土豆 |
|
| 实验现象 |
反应速率 |
很慢 |
稍快 |
较快 |
| 产生气泡 |
很少 |
比1中多 |
较多 |
|
| 复燃情况 |
不复燃 |
复燃 |
很快复燃 |
|
| 实验结论 |
[实验探究2]探究浓度对过氧化氢分解速率的影响:
取10ml30%的过氧化氢三份,将其中两份分别稀释为不同浓度的溶液,同时测定收集到100ml氧气所用的时间,(其它实验条件均相同)记录如下:
| 实验编号 |
1 |
2 |
3 |
| 过氧化氢溶液浓度 |
5% |
15% |
30% |
| 所用时间(秒) |
205 |
25 |
3 |
| 实验结论 |
[实验条件3]用上述收集的仪器与不同位置进行反应,其中有一固体能在氧气中燃烧,发出明亮的蓝紫色火焰,生成刺激性气味的气体,该反应的化学方程式为:。