六个未贴标签的试剂瓶中分别装有以下稀溶液①FeSO4、②H2SO4、③BaCl2、④H2O2、⑤Al(NO3)3、⑥NaOH。
(1)某同学想不用其它试剂,仅通过用试管取少量上述溶液进行两两混合实验而给试剂瓶贴上正确的标签,她能成功吗? (填“能”或“不能”)。
(2)实验中发现,有一组在混合时,随着试剂滴加的顺序不同而出现明显不同的现象,该组是 ,有一组在混合时.随着试剂滴加后的时间不同而出现明显不同的现象,该组是为 ,该组涉及氧化还原应的化学方程式 。
(3)鉴别后,该同学又用FeSO4做了三个体现Fe2+还原性的实验,每次加入上述两种已鉴别的物质的溶液与其混合。试写出其中两个反应的离子方程式
(4)以下各种溶液不用任何外加试剂,就能实现鉴别的是
①Al(NO3)3 FeCl3 NaOH FeSO4 NaHCO3
②Na2CO3 BaCl2 AgNO3 Na2SO4 NH3·H2O
③KOH NaCl NaHCO3 MgSO4 KNO3
④CuSO4 KHSO4 NaHCO3 KOH
⑤NaAlO2 Na2SiO3 Na2CO3 NaHSO4 NaCl
⑥NH4Cl Na2SO4 (NH4)2SO4 Ba(OH)2 AlCl3
(12分)已知反应:①SO3+H2O===H2SO4、②3NO2+H2O===2HNO3+NO
③2F2+2H2O===4HF+O2、④2Na+2H2O===2NaOH+H2↑、
⑤Na2O+2HCl===2NaCl+H2O、⑥SiO2+2NaOH===Na2SiO3+H2O
(1)上述反应中不属于氧化还原反应的有______________________ (填序号,下同).
H2O被氧化的是______,H2O被还原的是______.属于氧化还原反应,但其中的H2O既不被氧化又不被还原的是__________________.
(2) 用双线桥分析反应②:______________________________________________.
(3) 用单线桥标出反应③的电子转移方向和数目_________________________.
(4)写出反应④的离子方程式:______________________________________________.
(6分)有以下几种物质①干燥的食盐晶体 ②液态氯化氢 ③水银 ④蔗糖 ⑤纯硫酸 ⑥KNO3溶液填空回答:(填序号)
(1)以上物质能导电的是____________
(2)以上物质中属于电解质的是____________ 。
(3)以上物质中属于非电解质的是____________ 。
硫酸盐有着广泛的应用。
(1)以下是CuSO4·5H2O的实验室制备流程图。
根据题意完成下列填空:
① 理论上,为了制得纯净的CuSO4·5H2O晶体,需要消耗稀硫酸、稀硝酸溶质物质的量之比为,发生反应的离子方程式为。
② 实际生产过程中对所加稀硝酸的浓度控制要求比较高,通常用标准氢氧化钠溶液来滴定。滴定过程中若用酚酞作指示剂,终点现象是。请在下图中画出滴定过程中溶液的pH随所滴加氢氧化钠溶液体积的变化的曲线图(要求过A点)。
③用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1mol Cu2 (OH)2CO3后恰好恢复到电解前的浓度和pH(不考虑CO2的溶解)。则电解过程中共转移电子的物质的量为
(2)为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量溶液,产生白色沉淀。
②、、(依次填写实验操作名称)。
③冷却、称重。
若试样为m g,沉淀的物质的量为n mol,则试样中K2SO4的物质的量为:mol.
(用含m、n的代数式表示)。
(3)PbSO4难溶于水却可溶于醋酸,你认为可能的原因是
①醋酸铅可溶于水 ②醋酸铅是弱电解质
③醋酸铅在水中形成电离平衡时的c(Pb2+)小于PbSO4的溶解平衡的c(Pb2+)
⑤因醋酸是弱酸,故反应可进行
现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
| 阳离子 |
H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 |
OH-、C1-、CO32--、NO3-、SO42- |
已知:
①A、B两溶液呈碱性;C、D、E溶液呈酸性。
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀不包括微溶物,下同)。
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀。
试回答下列问题:
(1)将C溶液逐滴加入等体积、等物质的量的浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为:。
(2)已知:NaOH(aq)+HNO3(aq)= NaNO3(aq)+H2O(1) △H=-a KJ·mol-1。请写出B与C的稀溶液反应的热化学方程式。
(3)写出E溶液与过量的B溶液反应的离子方程式。
(4)在100mL0.1mol·L-1E溶液中,逐滴加入35mL 2mol·L-1NaOH溶液,最终得到的沉淀的物质的量为。
A、B、C、D是四种短周期元素,它们的原子序数依次增大。其中A、D元素同主族,B、C元素同周期;由A、B、C、D中的两种元素可形成原子个数比为1:1的多种化合物,甲、乙、丙、丁为其中的四种,它们的元素组成如下表所示: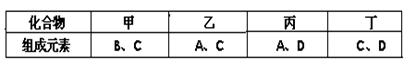
常温下,甲物质为气体,密度略小于空气;乙物质为液体;丙物质和丁物质为固体且都为离子化合物。请填写下列空白:
(1)丙物质的化学式为,丁物质中阴离子与阳离子的个数之比为。
(2)若标准状况下5.6L甲物质完全燃烧放出的热量为akJ,试写出表示甲物质燃烧热的热化学方程式。
(3)研究表明乙物质具有弱酸性,则乙物质在水中的电离方程式为。
(4)某同学设计了一个以结构简式是BA3-CA的物质为燃料的电池,并用该电池电解200mL一定浓度的NaCl与CuSO4的混合溶液,其装置如下图: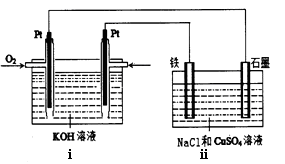

①写出ⅰ中通入该物质这一极的电极反应式。
②理论上ⅱ中两极所得气体的体积随时间变化的关系如坐标图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式;在t2时所得溶液的pH约为。