下图为实验室制取纯净、干燥的Cl2,并进行检验Cl2性质实验的装置。其中E瓶中放
有干燥红色布条;F中为铜网,右端为一团棉花。
|
|
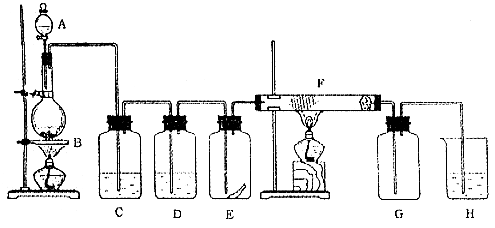
在实验室鉴定氯酸钾晶体和1氯丙烷中的氯元素,现设计了下列实验操作程序:①滴加AgNO3溶液;②加NaOH溶液;③加热;④加催化剂MnO2;⑤加蒸馏水,过滤后取滤液;⑥过滤后取滤渣;⑦用HNO3酸化。
(1)鉴定氯酸钾中氯元素的操作步骤是____________(填序号)。
(2)鉴定1氯丙烷中氯元素的操作步骤是____________(填序号)。
(15分)为了探究乙二酸的不稳定性、弱酸性和还原性,某化学兴趣小组设计了如下实验。
[查阅资料]乙二酸俗称草酸,草酸晶体(H2C2O4·2H2O)在100°C时开始升华,157°C时大量升华 并开始分解;草酸蒸气在低温下可冷凝为固体且草酸钙不溶于水,草酸蒸气能使澄清石灰水变浑浊。
I、乙二酸的不稳定性:
根据草酸晶体的组成,猜想其受热分解产物为CO、CO2和H2O。
(1)请用下列装置组成一套探究并验证其产物的实验装置,
请回答下列问题: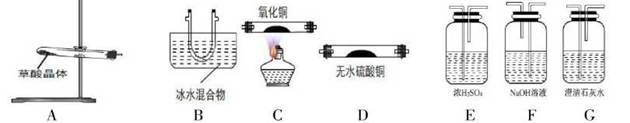
①装置的连接顺序为:A→B→→→F→E→C→G。
②装置中冰水混合物的作用是。
③能证明产物中C0的实验现象是。
④整套装置存在不合理之处为。
Ⅱ、乙二酸的弱酸性:
该小组同学为验证草酸性质需0.1mol·L-1的草酸溶液480ml。
(2)配置该溶液需要草酸晶体g。
(3)为验证草酸具有弱酸性设计了下列实验,其中能达到实验目的是。
| A.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色 |
| B.测定0.1molL-1草酸溶液的pH |
| C.将草酸溶液加入Na2CO3溶液中,有CO2放出 |
| D.测定草酸钠溶液的pH |
(4)该小组同学将0.1molL-1草酸溶液和0.1molL-1的NaOH等体积混合后,测定反应后溶液呈酸性,则所得溶液中各离子浓度由大到小的顺序为。
Ⅲ、乙二酸的还原性:
(5)该小组同学向用硫酸酸化的KMnO4溶液中滴入过量的草酸溶液,发现酸性KMnO4溶液褪 色,从而判断草酸具有较强的还原性。该反应的离子方程式为_。
硫代硫酸钠俗称保险粉,又名“大苏打”。可用于照相业作定影剂、纸浆漂白作脱氯剂,也可用于氰化物、砷、汞、铅、铋、碘等中毒的治疗,也是一种常用的实验试剂。
I.已知:Na2S2O3 + H2SO4 = Na2SO4 + S↓+ SO2 + H2O,某研究小组依据该反应探究外界条件对反应速率的影响,设计实验如下:
| 实验 编号 |
实验温度 /℃ |
Na2S2O3 |
H2SO4 |
蒸馏水体积 /mL |
||
| 体积/mL |
浓度/ mol·L-1 |
体积/mL |
浓度/ mol·L-1 |
|||
| ① |
25 |
10 |
0.1 |
10 |
0.1 |
0 |
| ② |
25 |
5 |
0.1 |
10 |
0.1 |
5 |
| ③ |
25 |
5 |
0.2 |
10 |
0.2 |
5 |
| ④ |
50 |
5 |
0.1 |
10 |
0.1 |
5 |
| ⑤ |
50 |
10 |
0.2 |
5 |
0.2 |
5 |
下列有关说法正确的是
A.实验①和②探究其他条件不变时Na2S2O3浓度对相关反应速率的影响
B.实验①和③溶液变浑浊的时间相同
C.其他条件不变时,探究温度对化学反应速率的影响,应选择实验③和⑤
D.该同学在实验中采用的研究方法是实验比较法
II.实验室用SO2通入Na2S和Na2CO3的混合溶液中来制备硫代硫酸钠。反应原理为:
2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2
本实验对Na2S纯度要求较高,利用图1所示的装置可将工业级的Na2S提纯。已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精。提纯过程为:将已称量好的工业级Na2S放入圆底烧瓶中,加入一定质量的酒精和少量水。按图1所示装配所需仪器,向冷凝管通入冷却水,同时水浴加热。待烧瓶中固体不再减少时,停止加热。将烧瓶取下,立即趁热过滤,再冷却结晶,过滤。将所得固体洗涤、干燥,得到Na2S·9H2O晶体。
(1)在提纯过程中“趁热过滤”操作的目的是 ;
(2)用图2所示装置制取Na2S2O3,其中盛放Na2SO3固体的玻璃仪器名称是 ,NaOH溶液的作用是 。
(3)保险粉样品中Na2S2O3·5H2O的纯度(质量分数)可通过氧化还原滴定法测定,相关反应方程式为
2Na2S2O3+I2=2NaI+Na2S4O6。
准确称取Wg样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂。用0.1000mol•L¯1碘的标准溶液进行滴定。
请回答:
①到达滴定终点的标志 ;
②滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为 mL,产品的纯度为 (设Na2S2O3•5H2O相对分子质量为M)。
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的纯度的测量结果 (填“偏高”、“偏低”或“不变”)。
(15分)海带是一种富含生物碘的海洋植物,碘是人体必需的微量元素,人体内碘的含量直接影响身体健康,为了防止缺碘,通常向食盐中加入碘酸钾(KIO3),以补充人体对碘的需求。已知:
| 乙醇 |
四氯化碳 |
裂化汽油 |
碘(晶体) |
|
| 密度/g·cm-3 |
0.789 |
1.595 |
0.71~0.76 |
4.93 |
| 沸点/℃ |
78.5 |
76.8 |
25~232 |
184.35 |
以下为某兴趣小组从海带提取碘单质的过程:
(1)实验室中焙烧海带时不能用到的仪器有________(填写相应的字母)。
A.泥三角
B.三脚架
C.烧杯
D.坩埚
E.蒸发皿
F.酒精灯
(2)向浸取液中加入足量的双氧水和稀硫酸时所发生反应的离子方程式为:。
(3)操作①中除用到玻璃棒外,还需要的玻璃仪器有;
(4)试剂A的名称为(从上表给出的试剂中选择)。
(5)操作②的名称为。
(6)下图是进行蒸馏时的部分仪器,图中缺少玻璃仪器的名称是 。
(7)工业上可用碘制取碘酸钾,其反应为:I2+2KClO3=2KIO3+Cl2↑,下列有关叙述不正确的是。
A.氧化性:I2>Cl2
B.每生成1 mol KIO3转移电子5 mol
C.该反应是置换反应
D.反应物和生成物中均含有共价键
氯化铁是一种重要的化学试剂和化工原料,工业上以黄铁矿(主要成分为FeS2)为原料在制备硫酸的同时,利用其煅烧后炉渣的主要成分Fe2O3可制备氯化铁晶体(FeCl3·6H2O),其工艺流程如下(杂质不参与反应):
回答下列问题:
(1)高温煅烧时,黄铁矿要粉碎成细小的颗粒,其目的是 。
(2)黄铁矿高温煅烧时发生反应的化学方程式 。
(3)酸溶及后续过程中均需保持盐酸过量,其目的是 、 。
(4)系列操作包括:蒸发浓缩、 、 、洗涤等。蒸发与过滤时玻璃棒的作用分别是: 、 。
(5)取a g黄铁矿,按上述流程制得FeCl3·6H2O晶体,将该晶体溶于水,再将所得溶液蒸干、灼烧,得到b g固体产物(整个过程中的损耗忽略不计),黄铁矿的纯度为 (用含a、b的表达式表示)。