金属结构和性质等是化学研究的重要内容.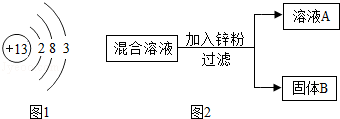
(1)如图1是铝的原子结构示意图.下列说法不正确的是 .
| A.铝原子的质子数为13 |
| B.化合物中铝元素通常显+3价 |
| C.铝是地壳中含量最多的元素 |
| D.铝可作导线是由于它具有良好的导电性 |
(2)工业上用CO和赤铁矿石炼铁的化学方程式为 .
(3)R是银白色金属,将稀盐酸分别加入到盛有金属Fe、R、Cu的试管中,只有Cu表面无现象;将 FeSO4溶液中分别加入到盛有金属R、Cu的试管中,只有R表面有黑色物质析出,则金属H、Fe、R、Cu活动性由强到弱的顺序是 .
(4)某化学小组用一定量AgNO3和Cu(NO3)2混合溶液进行了如图2所示实验,下列关于溶液A中的溶质不合理的猜想及其理由是 .
猜想1:只有Zn(NO3)2
猜想2:Zn (NO3)2、AgNO3
猜想3:Zn (NO3)2、Cu(NO3)2猜想4:Zn (NO3)2、AgNO3、Cu(NO3)2
若“猜想1”成立,通过实验确定固体B的成分的
方案是
金属材料用途广泛,回答下列问题:
(1)人们大量使用的是合金而不是纯金属,是因为合金具有更多优良性能.例如钢铁比纯铁硬度 _________ (填“大”或“小”).
(2)钢铁表面刷油漆,目的是阻止铁与空气中的氧气、________接触而生锈,若要检测钢铁表面的油漆是否破损,可在油漆表面涂上CuSO4溶液,其原理是 _________ (用化学方程式表示).
(3)锰钢是制造坦克装甲的原料.已知,镁能置换出MnSO4溶液中的Mn,而铁不能,则Mn、Fe、Mg、Cu四种金属的活动性由强到弱的顺序为 _________ .
(4)金属资源是有限的,我们要珍惜和保护它,有效途径是 _________ (只写一点).
有些汽车安装了安全气囊,气囊中装有“叠氮化钠”(NaN3)等固体粉末。一旦汽车发生强烈的意外碰撞,传感器将激活特定的电路放电,叠氮化钠迅速分解生成钠并放出氮气(N2),使安全气囊打开,起到保护作用。此后气体通过气囊上的小孔迅速消散,气囊收缩。
(1)写出叠氮化钠在放电条件下分解的化学方程式:。
(2)写出安全气囊中选用叠氮化钠的理由:。
现有①氧气 ②氯化钾 ③铁 ④二氧化碳 ⑤氧化镁 ⑥冰水混合物 ⑦高锰酸钾加热制氧气后的剩余物⑧空气 ⑨高锰酸钾 ⑩氮气九种物质,其中属于混合物的是(填序号,下同)____________;属于单质的是________________;属于氧化物的是____________;含有氧分子______________能使带火星木条复燃的是(填化学式,下同)____________;充入灯泡中作保护气的气体是。
用适当的符号填空
⑴ 碳酸根离子⑵ 四个硫原子
⑶ 保持水化学性质的最小粒子 _____⑷ 构成氯化钠的阳离子_____________
⑸ 空气中含量最多的元素________ ⑹ 氯化铝中铝元素显+3价__________。
被称为“绿色氧化剂”的过氧化氢(H2O2),俗称双氧水,是一种无色液体,常用作氧化剂、消毒杀菌剂和漂白剂等。在较低温度下和少量催化剂(如MnO2)条件下,它能迅速分解,生成氧气和水。请回答下列问题: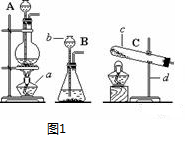
(1)、若实验室用过氧化氢代替氯酸钾制取氧气, 可采用上面的哪种发生装置?
(填序号“A”、“B”、“C”),主要理由是。
(2)、当过氧化氢接触二氧化锰后,反应便立即开始并不能人为控制其速度。如果稍改变你所选择的装置,便可控制其反应的速度。请从图2的仪器中选择一种仪器更换你选择的装置中的一种仪器,以达到控制反应速度的目的。你选择的仪器是(填序号),它更换原装置中的。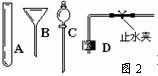
(3)、天然气、沼气的主要成分是甲烷(CH4),它是无色无味的气体,密度比空气小,极难溶于水,能燃烧。实验室用无水醋酸钠和碱石灰固体混合物加热制取甲烷气体。若用此法制取甲烷气体,其气体发生装置选择,(从图1A、B、C中选择)要收集较纯净的甲烷可采用收集。