第三代混合动力车,可以用电动机、内燃机或二者结合推动车辆。汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车或下坡时,电池处于充电状态。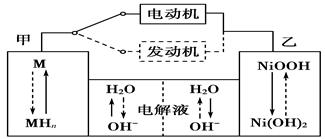
(1)混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液。镍氢电池充放电原理示意如图,其总反应式为H2+2NiOOH 2Ni(OH)2。根据所给信息判断,混合动力车上坡或加速时,甲电
2Ni(OH)2。根据所给信息判断,混合动力车上坡或加速时,甲电
极周围溶液的pH________(填“增大”“减小”或“不变”),该电极的电极反应_________。
(2)Cu2O是一种半导体材料,可通过如图所示的电解装置制取,电解总反应式为
2Cu+H2O Cu2O+H2↑,阴极的电极反应式是_____________________。
Cu2O+H2↑,阴极的电极反应式是_____________________。
用镍氢电池作为电源进行电解,当电池中有1 mol H2被消耗时,Cu2O的理论产量为______g。
(3)远洋轮船的钢铁船体在海水中易发生电化学腐蚀中的________腐蚀。为防止这种腐蚀,通常把船体与浸在海水里的Zn块相连,该方法叫 ________。
已知:
Ⅰ. 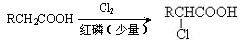
Ⅱ. 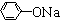 +RCl
+RCl
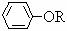 +NaCl
+NaCl
冠心平F是降血脂、降胆固醇的药物,它的一条合成路线如下: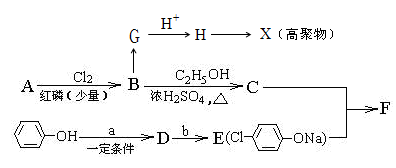
(1)A是饱和一元羧酸,8.8gA与足量NaHCO3溶液反应生成 2.24L(标准状况)CO2,则A的分子式为 。
(2)B是氯代羧酸,其核磁共振氢谱有两个峰,写出B水解生成化合物G的反应方程式: 。
(3)写出H ® X的化学方程式: 。
(4)D的苯环上有两种氢,其结构简式是 ,D具有的性质有 。
| A.可以发生消去反应、取代反应 |
| B.可以发生加成反应、氧化反应 |
| C.在一定条件下,与氢氧化钠反应,最多消耗2molNaOH |
| D.能与FeCl3溶液发生显色反应 |
(5)写出C ® F的化学方程式: 。
(6)聚甲基丙烯酸酯纤维具有质轻、频率宽等特性,广泛应用于制作光导纤维。若用上述物质中的C通过2步反应合成高聚物Y(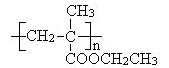 ),反应的化学方程式是:
),反应的化学方程式是:
第一步: ;
第二步: 。
(7)与B互为同分异构体的属于酯类的化合物共有 种(不含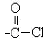 结构)。
结构)。
根据碘与氢气反应的热化学方程式,下列判断正确的是
① I2(g)+H2(g) 2HI(g)△H=-9.48 kJ/mol
2HI(g)△H=-9.48 kJ/mol
② I2(s)+H2(g) 2HI(g)△H=+26.48 kJ/mol
2HI(g)△H=+26.48 kJ/mol
(1)写出固态碘生成气态碘的热化学方程式:。
(2)若反应②吸收52.96kJ热量时,转移电子的物质的量是mol。
(3)对于在恒温、恒容密闭容器中进行的反应①,能说明其达到化学平衡状态的是。
A. 容器中气体压强不变
B. 容器中气体密度不变
C. 容器中气体颜色的深浅不变
D. 有n个H—H键断裂的同时有2n个H—I键断裂
(4)可通过反应2NO+O2=2NO2和NO2+2H++2I-=NO+I2+H2O来制取碘,NO在制碘过程中的作用是。
(5)硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放。某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,采用以下方案:如下图所示,图中气体流量计B用于准确测量通过的尾气体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液的蓝色消失时,立即关闭活塞A。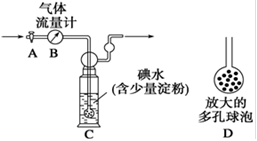
①用碘水测定SO2的含量的化学方程式是。
②洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是。
③洗气瓶C中溶液的蓝色消失后,没有及时关闭活塞A,测得的SO2含量_________(填“偏高”、“偏低”或“无影响”)。
有A、B、C、D、E五种元素,元素A的一种原子无中子,元素B和C都有2 个电子层,它们能生成无色无味的气体BC2,元素D有三个电子层,它和元素C属于同一主族,D和C生成有刺激性气味的气体DC2;元素E的阳离子E+的电子层结构与Ar的电子层结构相同,试回答:
(1)元素名称是: A______B______C______D_____E________。
(2)C元素位于第________周期,第________族
(3)B的最高价氧化物与E的最高价氧化物对应水化物反应
的离子方程式:
(4)A和D的化合物与C和D的化合物(DC2)能否反应?
若能反应写出反应方程式。
在第3周期中,原子半径最大的金属元素是,(填元素符号,下同)离子半径最小的离子是,化学性质最稳定的元素是,最高价氧化物对应水化物的酸性最强的化合物的化学式是,最高价氧化物对应水化物的碱性最强的化合物的化学式是,显两性的氢氧化物的化学式是,该两性氢氧化物与盐酸、氢氧化钠溶液分别反应的离子方程式为、。
(1)H218O和D2O分子中的中子数,前者和后者的关系是(填序号,下同)
a.大于 b.小于 c.等于 d.无法确定
(2)化学变化中,可能发生改变的是
a.质子数b.中子数 c.核外电子数d.原子核
(3)右图为周期表的一部分,已知A,B,C,D,E五种元素,原子核外共有85个电子,E原子核外有四个电子层,B元素是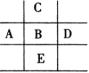
a.P b.Mg c.Cl d. Si