为测定某H2C2O4溶液的浓度,取25.00mL该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定。滴定原理为:
2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
(1)滴定时,KMnO4溶液应装在 (填“酸式滴定管”或“碱式滴定管” )中,达到滴定终点的现象为 。
(2)若滴定时,没用标准液洗涤滴定管,会使得草酸溶液的物质的量浓度_ _ (填“偏高”“偏低”“无影响”)
(3)若滴定时,反应前后的两次读数分别为a和b,则实验测得所配草酸溶液的物质的量浓度为 mol/L。
(4)在该溶液与KOH溶液反应所得的0.1 mol/L KHC2O4溶液中,c(C2O42-)>c(H2C2O4),下列关系正确的是 。
| A.c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-) |
| B.c(HC2O4-)+ c (C2O42-)+ c(H2C2O4)=0.1mol/L |
| C.c(H+)<c(OH-) |
| D.c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-) |
利用含锰废水(主要含Mn2+、SO42-、H+、Fe2+、Al3+、Cu2+)可制备高性能磁性材料碳酸锰(MnCO3)。其中一种工业流程如下:
已知某些物质完全沉淀的pH值如下表:
| 沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Cu(OH)2 |
Mn(OH)2 |
CuS |
MnS |
MnCO3 |
| 沉淀完全时的PH |
3.7 |
5.2 |
6.4 |
9.8 |
≥0 |
≥7 |
≥7 |
回答下列问题:
(1)若下列物质均能把Fe2+氧化为Fe3+,则过程①中可选择加入的氧化剂是。
a.Cl2b.MnO2 c.浓HNO3 d.H2O2
(2)过程②中,所得滤渣的成分是。
(3)过程③中,搅拌的目的是,发生反应的离子方程式是。
(4)过程④中,若生成的气体J可使澄清石灰水变浑浊,则生成MnCO3反应的离子方程式是___________。
(5)由MnCO3可制得重要的催化剂MnO2,MnCO3 + O2 → MnO2 + CO2。
O2 → MnO2 + CO2。
现在空气中加热 460.0 g的MnCO3,得到332.0 g产品,若产品中杂质只有MnO,则该产品中MnO2的质量分数是。(摩尔质量/g·:MnCO3 115 MnO2 87 MnO 71)
以聚甲基丙烯酸羟乙基酯(HEMA)为材料,可制成软性隐形眼镜。其合成路线图如下: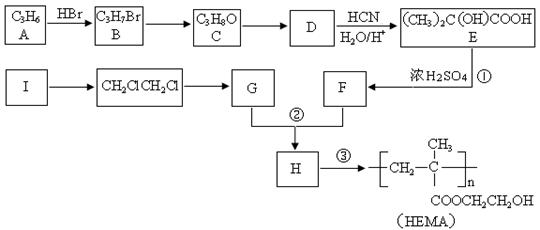
已知: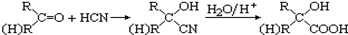
回答以下问题:
(1)A的官能团的名称是
(2)反应①的反应类型是
(3)写出下列反应的化学方程式
反应②
反应③
(4)下列说法正确的是(选填字母)
a.I具有顺反异构现象
b.G可以使酸性高锰酸钾褪色
c.F的核磁共振氢谱有三种峰,其峰面积之比为1:2:3
d.D可以发生银镜反应
(5)F可以与氢气发生加成反应,加成后的产物有多种同分异构体,其中含-COO-的有
种,写出其中一种的结构简式。
已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系: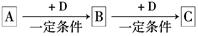
(1)若A能使湿润的红色石蕊试纸变蓝;C为红棕色气体。则A转化为B反应的化学方程式为。
(2)若D是金属,C溶液在贮存时应加入少量D,其理由是(用必要的文字和离子方程式说明)。
(3)若D是一种常见的温室气体,A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子,固体C受热分解可得固体B,该反应的化学方程式是。
(4)若D为氯碱工业的主要产品,B具有两性,则B转化为C的离子方程式为。
(5)若A、B、C均为氧化物,D是一种黑色固态非金属单质,则元素D在周期表中的位
置是,B分子的结构式为。
如下图装置所示,是用氢氧燃料电池B进行的某电解实验: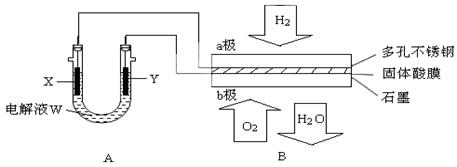
(1)若电池B使用了亚氨基锂(Li2NH)固体作为储氢材料,其储氢原理是:
Li2NH+H2=LiNH2+LiH ,则下列说法中正确的是。
| A.Li2NH中N的化合价是-1 |
| B.该反应中H2既是氧化剂又是还原剂 |
| C.Li+和H+的离子半径相等 |
| D.此法储氢和钢瓶储氢的原理相同 |
(2)在电池B工作时:
① 若用固体Ca(HSO4)2为电解质传递H+,则电子由 极流出,H+向极移动。(填“a”或“b ”)
② b极上的电极反应式为:
③ 外电路中,每转移0.1 mol电子,在a极消耗L的H2(标准状况下)。
(3)若A中X、Y都是惰性电极,电解液W是滴有酚酞的饱和NaCl溶液,则B工作时:
① 电解池中X极上的电极反应式是。在X极这边观察到的现象是。
② 检验Y电极上反应产物的方法是。
③ 若A中其它均不改变,只将电极Y换成铁棒,可实现的实验目的是。
在450℃并有催化剂存在下,在体积为1L的密闭恒温容器中,二氧化硫和氧气发生如下反应:2SO2+O2 2SO3
2SO3
(1)已知:64g SO2完全转化为SO3会放出85kJ热量。SO2转化为SO3的热化学方程式是。
(2)该反应的化学平衡常数表达式K= 。
(3)降低温度,化学反应速度。该反应K值将。压强将。(填“增大”或“减小”或“不变”)
(4)450℃时,在一密闭容器中,将二氧化硫与氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间段是。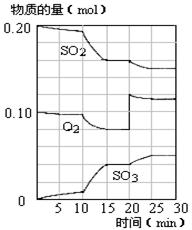
a.10-15min b.15-20min c.20-25min d.25-30min
(5)据图判断,10min到15min的曲线变化的原因可能是(填写编号)。
a.增加SO3的物质的量 b.缩小容器体积 c.降低温度 d.催化剂
(6)在15分钟时,SO2的转化率是。