已知:2SO2(g)+O2(g) 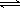 2SO3(g);△H=-196 kJ/mo1,850K时,在2L固定容积的密闭容器中充入2mol SO2和2mol O2,10分钟后达到平衡,SO2浓度和时间关系如图。
2SO3(g);△H=-196 kJ/mo1,850K时,在2L固定容积的密闭容器中充入2mol SO2和2mol O2,10分钟后达到平衡,SO2浓度和时间关系如图。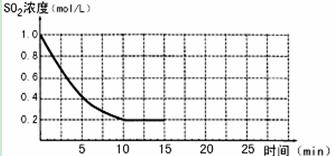
回答下列问题
(1)前10分钟内O2的平均反应速率为 mol/(L·min)
(2)平衡时,02的转化率为 ,此时反应共放热 kJ。
(3)若15分钟时维持温度不变,压缩容器体积,使其体积变为1L,假设在20分钟时达到新平衡,此时c(O2)=1.15 mol/L,请在图上画出15-25分钟SO2的浓度变化曲线。
(8分)(1)实验室在临时配制一些氯化铁溶液时,常将氯化铁固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,是为了。氯化铁水溶液呈性,原因是(用离子方程式表示):。
(2)物质的量浓度均为0.1 mol/L的下列溶液pH 由大到小的顺序
(用序号表示)
①CH3COOH②NH4Cl③NaHCO3④Ba(OH)2⑤NaOH⑥N a2CO3
(3)物质的量浓度相同的下列溶液按c(CO32-)由大到小的顺序是____________
①Na2CO3②NaHCO3③H2CO3④ (NH4)2CO3⑤NH4HCO3
某非金属单质A经如下图所示的过程转化为含 氧酸D,已知D为强酸,请回答下列问题:
氧酸D,已知D为强酸,请回答下列问题: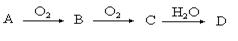
(1)若A常温下为淡黄色固体,B是有刺激性气味的无色气体。
①A的化学式:
②工业生产中大量排放的B气体被雨水吸收后形成 而污染环境。
③写出B→C反应的化学方程式:
(2)若A在常温下为气体,C是红棕色气体。
①A、C的化学式分别是:A ,C
②写出B→C反应的化学方程式:
利用氧化还原反应原理配平
⑴ NH3 + O2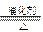 NO + H2O
NO + H2O
⑵ FeSO4 + KNO3 + H2SO4 = K2SO4 + Fe2(SO4)3 + NO↑+ H2O
浓硫酸在下列用途和现象中所表现的性质是
| A.沸点高、难挥发 | B.酸性 | C.吸水性 | D.脱水性 E.强氧化性 |
| 用途或现象 |
体现浓硫酸的性质 |
( 1)浓硫酸使胆矾变成白色 1)浓硫酸使胆矾变成白色 |
|
| (2)浓硫酸使蔗糖变”黑面包” |
|
| (3)浓硫酸与铜片共热 |
|
| (4)浓硫酸的木炭共热产生气体 |
(16分) 373 K时,某1 L密闭容器中加入1molPCl5发生如下可逆反应: PCl5 (g) PCl3(g) + Cl2 (g)。其中物质PCl3的物质的量变化如图所示。
PCl5 (g) PCl3(g) + Cl2 (g)。其中物质PCl3的物质的量变化如图所示。
(1)前20 s内PCl5(g)的平均反应速率为
(2)373 K时该反应的平衡常数的值为
(3)若在此平衡体系中再加入1mol的PCl5,与原平衡比较,新平衡时PCl5的转化率(填“增大”或“减小”,下同)。PCl5的平衡浓度
(4)将原平衡升温至473 K,重新达平衡时(其他条件不变),PCl3的平衡浓度为PCl5的3倍,该反应的正反应为(填“放热反应”或 “吸热反应”),为增大平衡体系中Cl2的物质的量,下列措施正确的是(其它条件相同)
a.升高温度 b.扩大容器的体积
c.加入合适的催化剂 d.再充入PCl3