某种碳酸锰矿的主要成分有MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3等。已知碳酸锰难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如下:

阴离子膜法电解装置如下图所示:

(1)写出用稀硫酸溶解碳酸锰反应的离子方程式: 。
(2)已知Ksp (Fe(OH)3) =" 4" ´10–38,假设溶液中Fe3+离子浓度为0.1 mol·L–1,则开始生成Fe(OH)3沉淀的pH是_________,沉淀完全的pH是_________。(可能用到的数据:lg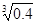 = -0.1 lg
= -0.1 lg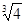 =0.2)
=0.2)
(3)已知不同金属离子生成氢氧化物沉淀所需的pH如下表:
| 离子 |
Fe3+ |
A13+ |
Fe2+ |
Mn2+ |
Mg2+ |
| 开始沉淀的pH |
1.2 |
3.7 |
7.0 |
7.8 |
9.3 |
| 沉淀完全的pH |
3.7 |
4.7 |
9.6 |
9.8 |
10.8 |
加氨水调节溶液的pH等于6,则“滤渣(待处理)”的成分是 (写化学式),滤液中含有的阳离子有H+和 (写符号)。
(4)在浸出液里锰元素只以Mn2+的形式存在,且滤渣A中也无MnO2,请用离子方程式解释原因: 。
(5)电解装置中箭头表示溶液中阴离子移动的方向,则A电极是直流电源的 极。实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为 。
(6)该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式: 。
A、B、C、D、E都是短周期元素,原子序数逐渐增大,原子半径按B、A、E、D、C依次增大。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子数多3个。E是地壳中含量最高的金属元素。根据以上信息回答下列问题:
(1)D元素在周期表中的位置是__________。
(2)甲物质的电子式是__________。
(3)E的单质加入到C的最高价氧化物对应的水化物的溶液中反应的离子方程式是。
(4)用电子式表示A的气态氢化物的形成过程。
有H、C、O、Cl、Na五种元素。
(1)由两种元素组成的四原子离子化合物的电子式__________________,由两种元素组成的三原子共价化合物的电子式______________。(各写1种)
(2)在由三种元素组成的化合物里,其中离子化合物的化学式_____________,共价化合物的化学式______________________。(组成元素不能完全相同)(各写2种)
(7分)常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 0.1000 mol/L HCl溶液和20.00 mL 0.1000 mol/L CH3COOH溶液,得到2条滴定曲线,如下图所示:
(1)由A、C点判断,滴定HCl溶液的曲线是______(填“图1”或“图2”);
(2)a=________ mL;(3)c(Na+)=c(CH3COO-)的点是________
(4)E点对应离子浓度由大到小的顺序为____________________________________。
(5)该温度下CH3COOH的电离常数为_____________________(列式代入数据计算)
(6) 当NaOH溶液滴定CH3COOH溶液过程中,NaOH溶液消耗了10.00 mL时, 则此时混合液中c(CH3COOH)_______ c(CH3COO-)(“>”或“<”或“=”).
(7) t℃时,浓度均为0. 0035mol/L的CH3COONa和NaOH的混合液pH=11,则溶液中c(H+) + c(CH3COO-) +2 c(CH3COOH) =____________(t℃时,Kw =4×10-14 mol2/L2)
(1)Na2CO3俗称纯碱,因CO32-水解而使其水溶液呈碱性,其实质促进了水的电离,水的Kw (“增大”或“减小”或“不变”),试写出CO32-水解的离子方程式 。加水稀释后,pH(“增大”或“减小”或“不变”,下同),c(HCO3-)/c(CO32-) 。
(2)25℃时,某HCl溶液中c(H+)=1×10-4 mol/L,则该溶液中c (OH-)= ,
(3)某温度(t℃)时,测得0.01mol·L-1 ,100ml的NaOH溶液的pH=11,
①则该温度下水的Kw= 。
②加水稀释后pH=10, 则应加入ml的水。(忽略混合后体积的变化,下同)。
③该温度下将pH=2的硫酸和pH=13的氢氧化钠溶液混合后溶液呈中性,则硫酸和氢氧化钠溶液的体积比=_________
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。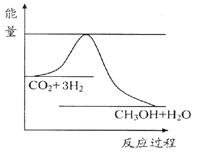
(1)关于该反应的下列说法中,正确的是。(填字母)
A.△H>0,△S>0 B.△H>0,△S<0 C.△H<0,△S<0 D.△H<0,△S>0且在(填“较高”或“较低”)温度下有利于该反应自发进行。
(2)该反应平衡常数K的表达式为。
(3)下列情况不能说明该反应一定达到平衡的是
A.混合气体的平均平均相对分子质量不变 B.混合气体的压强不变
C.单位时间内生成3mol H—H键,同时生成2 mol H—O键
D.混合气体中c (CO2) : c (H2) =" 1" : 3
(4)温度降低,平衡常数K(填“增大”、“不变”或“减小”)。
(5)为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。从反应开始到平衡,用H2浓度变化表示的平均反应速率v(H2)为mol·L-1·min-1, CO2和H2的转化率比是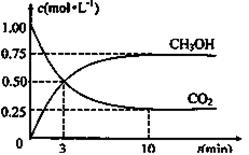
(6)下列措施中能使(5)题中n(CH3OH)/n(CO2)增大的有。(填字母)
A.升高温度 B.加入催化剂 C.将H2O(g)从体系中分离
D.充入He(g),使体系总压强增大 E.再充入1molCO2和3molH2
(7)若在另一个密闭容器中充入1 mol CO2和3 mol H2,保持压强不变,并使初始体积与题中容器体积相等,且在相同的温度下进行反应,达到平衡时该容器中的CO2的体积百分数 ________(5)题中的CO2的体积百分数。(“>”或“<”或“=”,下同)
(8)若为两个容积相同的密闭绝热容器,现向甲容器中充入1 mol CO2(g)和3 molH2(g),乙容器中充入1mol CH3OH(g)和1 mol H2O(g),在相同的温度下进行反应,达到平衡时,甲容器内n(CH3OH) 乙容器内n(CH3OH)。