按下图所示装置进行实验,并回答下列问题: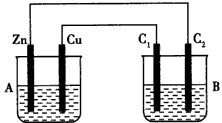

(1)判断装置的名称:A池为__________________,B池为________________________。
(2)铁极为_________极,电极反应式为________________________;铜极为________极,电极反应式为________________________ ;石墨棒C1为_______极,电极反应式为____________________________;石墨棒C2附近发生的实验现象为________,反应结束后,B池溶液的pH值________。(增大、减小、不变,忽略气体溶于水)
(3)当C2极析出224 mL气体(标准状况下),铁的质量________(增加或减少)__________g
(10分)甲醇合成反应为:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
(1)合成甲醇的反应过程中物质能量变化如图所示。写出合成甲醇的热化学方程式。
(2)实验室在lL密闭容器中进行模拟合成实验。将1 mol CO和2 mol H2通入容器中,分别恒温在300 ℃和500 ℃反应,每隔一定时间测得容器中甲醇的浓度如下:(表中数据单位:mol•L—l)
| 温度\时间 |
10min |
20min |
30min |
40min |
50min |
60min |
| 300 ℃ |
0.40 |
0.60 |
0.75 |
0.84 |
0.90 |
0.90 |
| 500 ℃ |
0.60 |
0.75 |
0.78 |
0.80 |
0.80 |
0.80 |
①300 ℃时反应开始10分钟内,H2的平均反应速率为;
②500 ℃时平衡常数K的数值为;
③300 ℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是(选填编号)。
a.c(H2)减小
b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加
d.重新平衡时 减小
减小
(3)下图是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。
①甲中负极的电极反应式为;
②乙中A极析出的气体在标准状况下的体积为;
③反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要mL5.0 mol•L—lNaOH 溶液。
(8分)元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)Cl2的电子式是。新制的氯水可用于漂白,工业上将氯气制成漂白粉的目的是,漂白粉是一种(填“混合物”或“纯净物”)。
(2)碘元素在元素周期表中的位置是;为防缺碘,食盐中常添加碘酸钾,该物质内存在键(填化学键类型)。
(3)溴单质是唯一常温下呈液态的非金属单质,液溴的保存通常采取的方法是。
(4)已知:X2(g)+H2(g) 2HX(g) (X2表示Cl2、Br2和I2)。下图表示平衡常数K与温度T的关系。
2HX(g) (X2表示Cl2、Br2和I2)。下图表示平衡常数K与温度T的关系。
① H表示X2与H2反应的晗变,H0。(填“>”、“<”或“=”)
H表示X2与H2反应的晗变,H0。(填“>”、“<”或“=”)
②曲线a表示的是(填“Cl2”、“Br2”或“I2”)与H2反应时K与T的关系。
选考[化学---选修3:物质结构与性质] (15分)
太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质。
(1)铟与镓同是IIIA族元素,写出铟基态原子的电子排布式:。
(2)硒为第四周期VIA族元素,与其相邻的元素有砷(33号)、溴(35号),则三种元素的电负性由小到大的顺序为。(用元素符号表示)
(3)SeO3分子的立体构型为。
(4)硅烷(SinH2n+2)的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是。
(5)硼元素具有缺电子性,其化合物往往具有加合性,如硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-,其中B原子的杂化类型为。
(6)金属铜投入氨水中或投入H2O2溶液中均无明显现象,但投入氨水—过氧化氢混合液中,则铜片溶解,溶液呈深蓝色,写出该反应的离子方程式:。
(7)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数比为;若该晶体的晶胞参数为a pm,则该合金密度为g/cm3。(列出计算式,不要求计算结果,阿伏伽德罗数的值为NA)
选考[化学---选修2:化学与技术]银、铜均属于重金属,从银铜合金废料中回收银并制备含铜化合物产品的工艺如图所示:
(1)熔炼时被氧化的元素是,酸浸时反应的离子方程式为。为提高酸浸时铜元素的浸出率及浸出速率,酸浸前应对渣料进行处理,其处理方法是。
(2)操作a是,固体B转化为CuAlO2的过程中,存在如下反应,请填写空白处:
CuO+Al2O3 +↑。
+↑。
(3)若残渣A中含有n mol Ag,将该残渣全部与足量的稀HNO3置于某容器中进行反应,写出反应的化学方程式。为彻底消除污染,可将反应中产生的气体与V L(标准状况)空气混合通入水中,
则V至少为L(设空气中氧气的体积分数为0.2)。
(4)已知2Cu+  Cu+Cu2+,试分析CuAlO2分别与足量盐酸、稀硝酸混合后,产生现象的异同点。
Cu+Cu2+,试分析CuAlO2分别与足量盐酸、稀硝酸混合后,产生现象的异同点。
(5)假设粗银中的杂质只有少量的铜,利用电化学方法对其进行精炼,则粗银应与电源的极相连,当两个电极上质量变化值相差30.4g时,则两个电极上银质量的变化值相差g。
锰锌铁氧体可制备隐形飞机上吸收雷达波的涂料。以废旧锌锰电池为原料制备锰锌铁氧体(MnxZn1-xFe2O4)的主要流程如下,请回答下列问题:
(1)酸浸时,二氧化锰被双氧水还原的化学方程式为。
(2)活性铁粉除汞时,铁粉的作用是(填“氧化剂”或“还原剂”或“吸附剂”)。
(3)除汞是以氮气为载气吹入滤液中,带出汞蒸汽经KMnO4溶液进行吸收而实现的。下图是KMnO4溶液处于不同pH时对应Hg的单位时间去除率变化图,图中物质为Hg与 MnO4-在该pH范围内反应的主要产物。
①pH<6时反应的离子方程式为。
②请根据该图给出pH对汞去除率影响的变化规律:。
③试猜想在强酸性环境下汞的单位时间去除率高的原因:。(不考虑KMnO4在酸性条件下氧化性增强的因素)
(4)当x=0.2时,所得到的锰锌铁氧体对雷达波的吸收能力特别强,试用氧化物的形式表示该锰锌铁氧体的组成。
(5)经测定滤液成分后,需加入一定量的MnSO4和铁粉,其目的是。