下表为元素周期表的一部分,请参照元素①一⑧在表中的位置,用化学用语回答下列问题: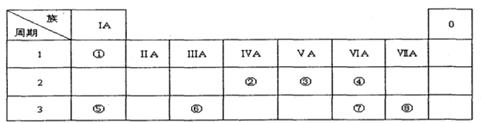
Ⅰ.(1)请画出元素⑧的阴离子结构示意图 。
(2)④、⑤、⑦的原子半径由小到大的顺序为 。
(3)⑤和⑥的最高价氧化物对应水化物的碱性强弱为 > 。
(4)④、⑤两种元素的原子按1:1组成的常见化合物的电子式为 。
Ⅱ.由表中①一⑧中的一种或几种元素形成的常见物质A、B、C可发生以下反应(副产物已略去),试回答: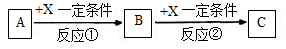
(1)若X是一种常见过渡金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,检验此C溶液中金属离子的方法是 ;又知在酸性溶液中该金属离子能被双氧水氧化,写出该反应的离子方程式 。
(2)若A、B、C为含有同一金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为 ,写出A与C两溶液反应的离子方程式____ 。
(1)相同物质的量浓度下的各溶液:NaX、NaY、NaZ,其PH值依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序为: ;
(2)将AlCl3溶于水后,经加热蒸发、蒸干,灼烧,最后所得白色固体的主要成分是 ;
(3)把a、b、c、d四种金属片浸泡在稀硫酸中,用导线两两相连,可以组成各种原电池。若a b相连,a为负极;c d相连,c为负极;a c相连,c为正极;b d相连,b为正极,则四种金属的活动性由强到弱顺序为: ;
(4)写出Na2CO3溶于水后的电离方程式: ________________________________________________________;
(5)写出氯化铁溶液水解反应的离子方程式: ______________________________________________;
A、B、C、D、E是核电荷数依次增大的5种短周期主族元素;原子半径按D、E、B、C、A顺序依次减小,B和E是同主族元素。
(1)下列推断正确的是
① A、B、E不可能在同一主族
② A、B、C可能在同一周期
③ C的最高价氧化物的水化物可能显碱性
④ C和D的单质可能生成离子化合物。
(2)若A与D同主族,B是形成化合物种类最多的元素,C原子的最外层电子数比A与B的最外层电子总数还多1。则A与C元素按原子个数比1:1形成的化合物F的电子式为;C与D形成的原子个数比为1:1的化合物19.5g与足量的水反应时,反应中所转移的电子的物质的量为mol。
根据下表列出的前20号元素中部分元素的性质数据,完成下列题目。
| 性质\编号 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
| 原子半径 |
1.52 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
0.71 |
| 最高正价 |
+1 |
+1 |
- |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
- |
| 最低负价 |
- |
- |
-2 |
- |
-4 |
-3 |
-1 |
- |
-3 |
-1 |
注:原子半径的单位是埃(10-10m)。
(1)(1分) 元素⑦在周期表中的位置:;
(2)(3分) 请写出编号为①、④、⑩的元素的名称:①、④、⑩;
(3)(2分)写出元素③和⑤形成的三原子分子的结构式、元素⑨的最高价氧化物对应的水化物的化学式。
(4)(4分) 写出下列物质的电子式:元素⑦和⑧形成的化合物、元素③与⑧及氢元素形成的碱;
(5)(2分) 现有三种物质:元素⑤的原子所形成的空间立体网状结构的物质A、元素③和⑤形成的有毒气体B、元素⑦和⑧形成的化合物C,请将A、B、C三种物质按熔点从高到低的顺序排列(用字母表示):。
(10分) 以铁、铜为两电极,稀硫酸为电解质所构成的原电池:
(1)导线中电流流向( 选填“铁”或“铜”) ,电极Fe是_____(选填“正”或“负”) 极,其电极反应式为;
(2)Cu电极的电极反应式为,发生反应(选填“氧化”或“还原”);
(3)该原电池反应的总反应式(写对应的离子方程式)是:,通过该原电池装置实现了从化学能向的转化。
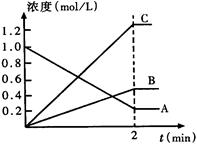
(6分) 右图表示800℃时,一个反应体系内A、B、C三种气体物质的浓度随时间变化的情况,t是反应时间。请回答:
(1)该反应的反应物是______。
(2)该反应的化学方程式为______。
(3)达到平衡状态的所需时间是2min,则该2min内A物质的平均反应速率为___ ____。