下列相关反应的离子方程式书写正确的是
| A.氢氧化铁溶于氢碘酸:Fe(OH)3+3H+ = Fe3++3H2O |
| B.硫酸铜溶液显酸性:Cu2+ + 2H2O ="=" Cu(OH)2↓+ 2H+ |
C.向碳酸氢铵溶液中加过量石灰水并加热:NH4++OH― NH3↑+H2O NH3↑+H2O |
| D.用酸化的高锰酸钾溶液氧化双氧水:2MnO4―+6H++5H2O2 = 2Mn2++5O2↑+8H2O |
已知H2(g)+Br2(g) = 2HBr(g) ΔH=-72 kJ/mol,其他相关数据如下表:
| H2(g) |
Br2(g) |
HBr(g) |
|
| 1 mol分子中的化学键断裂时需要吸收的能量/kJ |
436 |
a |
366 |
则表中a为
A.404 B.368C.224 D.200
在25℃、101 kPa下,0.1 mol甲醇燃烧生成CO2和液态水时放热72.65 kJ,下列热化学方程式正确的是
A.CH3OH (l)+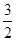 O2 (g) = CO2(g)+2H2O(l) ΔH=+726.5 kJ/mol O2 (g) = CO2(g)+2H2O(l) ΔH=+726.5 kJ/mol |
| B.2CH3OH (l)+3O2 (g) = 2CO2(g)+4H2O(g) ΔH=+1453 kJ/mol |
C.CH3OH (l)+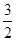 O2 (g) = CO2(g)+2H2O(l) ΔH=-726.5 kJ/mol O2 (g) = CO2(g)+2H2O(l) ΔH=-726.5 kJ/mol |
| D.2CH3OH (l)+3O2 (g) = 2CO2(g)+4H2O(g) ΔH=-1453 kJ/mol |
已知下列热化学方程式:C(s)+O2(g) = CO2(g) ΔH=-393.5 kJ·mol-1
2H2(g)+O2(g) = 2H2O(g) ΔH=-483.6 kJ·mol-1
现有0.2 mol的炭粉和氢气组成的气、固混合物在氧气中完全燃烧,共放出63.53 kJ热量,则炭粉与氢气的物质的量之比为
| A.1:1 | B.1:2 | C.2:3 | D.3:2 |
在一定温度下,在体积可变的容器中,进行可逆反应A(g) + B(g) C(g) + 2D(g);下列能说明该反应达到平衡状态的是
C(g) + 2D(g);下列能说明该反应达到平衡状态的是
①反应混合物的密度不再改变 ②混合气体的平均相对分子质量不再改变 ③C和D的物质的量之比为1:2 ④体系压强不再改变 ⑤C的质量分数不再改变 ⑥υ(A) : υ(C) =" 1:" 1
A.①②④⑤B.①②⑤C.②⑤⑥ D.①②③④⑤⑥
在2L的密闭容器中发生化学反应:2NO(g)+2CO(g) N2(g) +2CO2 (g) △H= -746.4kJ/mol。起始反应时NO和CO各为4mol,10秒后达到化学平衡,测得N2为1mol。下列有关反应速率的说法中,正确的是
N2(g) +2CO2 (g) △H= -746.4kJ/mol。起始反应时NO和CO各为4mol,10秒后达到化学平衡,测得N2为1mol。下列有关反应速率的说法中,正确的是
| A.反应前5秒钟内,用NO表示的平均反应速率为0.1mol/(L·s) |
| B.达到平衡后,升高温度,可以提高反应物的转化率 |
| C.达到平衡后,反应速率的关系有:υ正(CO) =2υ逆(N2) |
| D.保持容器体积不变,往容器中充入1molO2,正、逆反应速率都不改变 |