中学常见反应的化学方程式是:A+B→X+Y+H2O(未配平,反应条件略去),其中A、B的物质的量之比为1:4。请回答:
(1)若Y是黄绿色气体,该反应的离子方程式是 。
(2)若A为常见的非金属单质,B的溶液为某浓酸,其氧化产物的结构式为 ______
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中。含 a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是 mol。
(4)若A、B、X、Y均为化合物。向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色。则A与B按物质的量之比1:4反应后,溶液中溶质的化学式为 。
铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。已知:SiO2溶于NaOH溶液生成Na2SiO3和H2O,CaSiO3是沉淀。
①铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如下: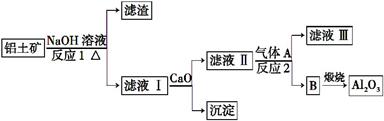
②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如下: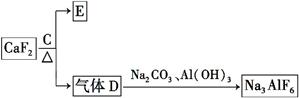
回答下列问题:
(1)写出反应1的化学方程式 。
(2)滤液Ⅰ中加入CaO生成的沉淀是 ,反应2的离子方程式为
。
(3)E可作为建筑装饰的材料,化合物C是 ,由D制备冰晶石的反应中另外一种生成物气体是 。
(4)电解制铝的化学方程式是 。
从明矾中提取K2SO4和Al2(SO4)3的主要操作有下列四步,下面是对每步操作提出的问题,请完成填空:
(1)将固体明矾用水溶解,加入过量的氨水,并过滤、洗涤沉淀。加过量氨水的目的是 ,
洗涤沉淀的目的是 。
(2)取沉淀加 直到沉淀完全溶解,再蒸发、结晶得 。
(3)取(1)的滤液,加稍过量的 溶液并加热,其目的是
;
再加入少量 中和多余的碱。
(4)对(3)所得的溶液加热、浓缩、结晶得 。
某混合溶液中可能含有HCl、MgCl2、AlCl3、NH4Cl、Na2CO3、KCl中的一种或几种物质,往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入的NaOH溶液体积(V)的关系如图所示。回答下列问题:
(1)溶液中一定含有的溶质是 ,一定不含有的溶质是 (填化学式)。
(2)溶液中可能含有的溶质是 (填名称),判断该物质是否存在的实验方法是 ,现象是 。
(3)分别写出AB段、BC段发生反应的离子方程式:
①AB段为 ;
②BC段为 。
下图所示是从铝土矿(主要成分是Al2O3,含Fe2O3、SiO2等杂质)中提取氧化铝的工艺流程之一。
已知:SiO2能和氢氧化钠反应,不和盐酸反应。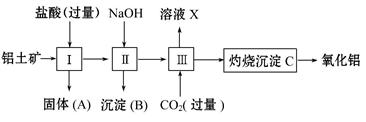
回答下列问题:
(1)用盐酸溶解铝土矿后,所得溶液中的阳离子有 。
(2)固体A的主要成分是 。
(3)进行操作Ⅱ时,为了达到分离要求,加入的NaOH应该 。
(4)进行操作Ⅲ时,一般通入过量CO2,其反应的化学方程式是
。
(5)溶液X和盐酸反应的离子方程式为
。
含镁3%~5%的镁铝合金,现已成为轮船制造、化工生产、机械制造等行业的重要原材料。现有一块已知质量为m1g的镁铝合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案:
实验设计1:
镁铝合金 溶液
溶液 得到沉淀的质量为m2g;
得到沉淀的质量为m2g;
实验设计2:
镁铝合金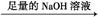 生成的气体在标准状况下的体积为V1L。
生成的气体在标准状况下的体积为V1L。
实验设计3:
镁铝合金 生成的气体在标准状况下的体积为V2L。
生成的气体在标准状况下的体积为V2L。
请回答以下问题:
(1)写出实验设计1中单质铝在第①步中发生反应的离子方程式:
。
(2)写出实验设计2中反应的离子方程式: 。
(3)判断这几种实验设计能否求出镁的质量分数,能求出的用题目提供的数据将镁的质量分数表示出来,不能求出的就空着不填。
①实验设计1: 。
②实验设计2: 。
③实验设计3: 。