酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式。SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备路线如下:
回答下列问题:
(1)SnCl2用盐酸而不用水直接溶解的原因是
加入锡粉的作用是
(2)反应I生成的沉淀为SnO,写出该反应的化学方程式:
(3)检验沉淀已经“洗涤”干净的操作是:
(4)反应Ⅱ硫酸的作用之一是控制溶液的pH。若溶液中c(Sn2+)=1.0mol·L—1,则室温下应控制溶液pH 。(已知:Ksp[Sn(OH)2]=1.0×10—26)
(5)酸性条件下,SnSO4还可用作双氧水的去除剂,试写出所发生反应的离子方程式:
。
(6)潮湿环境中,镀锡铜即使锡层破损也能防止形成铜绿,请结合有关的原理解释其原因:
。
现有前四周期的地五种主族元素A、B、C、D、E,A的最高价氧化物含A40%,A原子质子数等于中子数;B是同周期中除稀有气体外原子半径最大的元素;B和D能形成BD型离子化合物,且B、D两离子的电子层结构相同;C和D能形成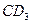 的化合物;C原子比E原子多1个电子;18gC与足量稀硫酸反应,所产生的氢气在标况下的体积为22.4L;C原子中质子数比中子数少1;D原子比A原子多一个质子。则:
的化合物;C原子比E原子多1个电子;18gC与足量稀硫酸反应,所产生的氢气在标况下的体积为22.4L;C原子中质子数比中子数少1;D原子比A原子多一个质子。则:
(1)五种元素的元素符号分别为
A、B、C、D、E、
(2)五种元素中,单质还原性最强的是,简单例子还原性最强的是
(3)A到E五种元素中最高价氧化物对应的水化物中,酸性最强的是碱性最强的是
(4)D单质与B的最高价氧化物对应的水化物的反应的离子方程式为
(5)B、C元素最高价氧化物的水化物之间的化学方程式为
前不久报道,我国“煤变油”技术已进入世界先进行列,科学家通过不懈努力,找到了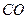 (由煤和水蒸气高温制得)应用的新方法,如:
(由煤和水蒸气高温制得)应用的新方法,如:
(1)合成汽油: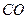 和
和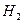 在443—473K的温度下用钴作催化剂,可合成碳原子数为5—8的烷烃。
在443—473K的温度下用钴作催化剂,可合成碳原子数为5—8的烷烃。
①写出 CO合成汽油 的化学方程式
的化学方程式
②若向密闭的合成塔里通入恰好能完全反应的CO和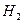 ,当完全反应时,气压降至原来的2/5,(温度不变),此时(填“有”或“没有”)汽油生成,理由是
,当完全反应时,气压降至原来的2/5,(温度不变),此时(填“有”或“没有”)汽油生成,理由是
③要达到上述合成汽油的要求,CO和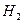 的体积比的取值范围是
的体积比的取值范围是
(2)合成甲醇:在390°C、3.03×105Pa时,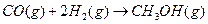 ,以n表示
,以n表示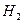 和
和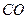 的物质的量之比,a表示
的物质的量之比,a表示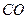 的转化率,x表示达到反应限度时混合物中
的转化率,x表示达到反应限度时混合物中 的体积分数,则
的体积分数,则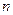 、a、x的关系式为。
、a、x的关系式为。
近年来,碳和碳的化合物在生产生活实际中应用广泛。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知:① 2 CH4 (g) + 3O2 (g) = 2 CO (g) + 4 H2O(l) △H1 =-1214.6 KJ/mol
② 2 CO (g) + O2(g) =2 CO2 (g) ΔH2 = -566 kJ/mol
则反应CH4(g) + 2 O2 (g) =CO2 (g) + 2 H2O (l) 的△H=。
(2)将两个石墨电极插人KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。通入CH4的一极,其电极反应式是:CH4 + 10 OH―― 8e-=CO32-+ 7 H2O;通入O2的一极,其电极反应式是。
(3)若用石墨做电极电解500 ml饱和食盐水,写出电解反应的离子方程式为:;电解一段时间后两极共收集到标准状况下的气体1.12 L(不考虑气体的溶解)。停止通电,假设反应前后溶液体积不变,则所得溶液的pH=。
(4)将不同量的CO (g) 和H2O (g) 分别通入到体积为2 L的恒容密闭容器中,进行反应
CO (g) +H2O (g)  CO2 (g) +H2 (g),得到如下三组数据:
CO2 (g) +H2 (g),得到如下三组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所 需时间/min |
||
| H2O |
CO |
CO2 |
CO |
|||
| 1 |
650 |
2 |
4 |
1.6 |
2.4 |
5 |
| 2 |
900 |
1 |
2 |
0.4 |
1.6 |
3 |
| 3 |
900 |
a |
b |
c |
d |
t |
① 实验1中以υ(H2)表示的反应速率为。
② 实验2中的平衡常数是(计算结果保留两位小数)。
③ 该反应的正反应为(填“吸”或“放”)热反应。
④若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),
则a、b应满足的关系是(用含a、b的数学式表示)。
A、B、C、D、E为短周期元素,其原子序数依次增大。其中,A元素原子半径最小;B元素原子的电子总数与最外层电子数之比为3 :2;C元素最高价氧化物对应水化物与其氢化物反应生成一种盐甲。A、E同主族,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物。请回答:
(1)写出B元素在周期表中的位置,C单质的电子式是____________。
(2)A、D、E组成的化合物乙与氯化亚铁溶液反应的实验现象为。
(3)常温下,甲的水溶液pH_______7(填>、<或=),其原因是(用离子方程式表示)_____________________。
(4)乙和B、D、E组成的化合物丙,它们的水溶液pH均为12时,两溶液中由水电离出的c(OH-),乙:丙=。
(5)A和B组成化合物丁,其相对分子质量为16。将右图装置放置在光亮的地方(日光没有直接照射),一会儿后,观察到量筒壁上有油状液滴生成等现象。油状液滴的成分可能是(写分子式)。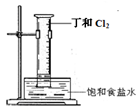
乙基香兰素是当今世界上最重要的合成香料之一,其结构简式如下图所示。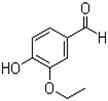
(1)以下推测正确的是(填字母)。
a.该物质能发生银镜反应
b.从分子结构上看,它应该属于芳香烃
c.1 mol该物质最多能与4 mol H2发生加成反应
d.该物质的一个分子内含有一个碳氧双键、三个碳碳双键
(2)乙基香兰素的同分异构体X,其分子中苯环上有2个取代基。X可以发生水解反应生成M和N两种有机物。M可与饱和溴水反应生成白色沉淀。N的质谱图显示相对分子质量为32,红外光谱图上发现有O—H键、C—H键和C—O键的振动吸收。写出2种符合上述要求的X的结构简式;。
(3)乙基香兰素的另一种同分异构体Y,分子中苯环上只有1个取代基,它可以和碳酸氢钠反应生成CO2。
① Y分子中含氧官能团的名称是。
②由Y→B的反应属于_______________(填反应类型)。
③ A与新制Cu(OH)2反应的化学方程式是。
④由B生成C的化学方程式是。
⑤ Y发生缩聚反应所得产物的结构简式是。