下列离子方程式书写正确的是
| A.碳酸氢钠与盐酸反应:CO32-+2H+=CO2↑+H2O |
| B.氯气溶于水:Cl2+H2O=2H++Cl-+ClO- |
| C.钠投入硫酸铜溶液中:2Na+Cu2+=2Na++Cu |
| D.碳酸氢钠溶液中加入烧碱溶液:HCO3-+OH-=CO32-+H2O |
丙烯醇(CH2=CH—CH2OH)可发生的化学反应有
①加成②氧化③燃烧④加聚⑤取代
| A.只有①②③ | B.①②③④ |
| C.①②③④⑤ | D.只有①③④ |
已知分子式为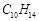 的有机物,只含一个取代基,可与液溴在铁粉的作用下反应生成一溴代物,则此烃的结构有
的有机物,只含一个取代基,可与液溴在铁粉的作用下反应生成一溴代物,则此烃的结构有
| A.2种 | B.3种 | C.4种 | D.5种 |
A、B两种有机物组成的混合物,当混合物的质量相等时,无论A、B以何种比例混合,完全燃烧时产生的CO2的质量都相等,一定符合这一条件的组合有:
①同分异构体 ②同系物 ③具有相同的最简式 ④含碳的质量分数相同
其中正确的是
A. ①②③ B. ①③④ C. ②③④ D. ①②③④
某气态烃1 mol最多和2 mol氢气发生加成反应,所得产物又能与10 mol氯气发生取代反应,最后得到一种只含碳、氯元素的化合物,则原气态烃为
| A.2-辛炔 | B.丙烯 | C.2-丁炔 | D.2-戊炔 |
乙烯和乙醇的混合气体VL,完全燃烧产生CO2和H2O,消耗相同状态下的O23VL,则混合气体中乙烯和乙醇的体积比为
| A.1:1 | B.2:1 | C.1:2 | D.任意比 |