某化学课外兴趣小组探究铜与浓硫酸的反应情况及某些产物的性质。
(Ⅰ)甲、乙两同学进行了下列实验:取一定量的铜片和20 mL 18 mol/L的浓硫酸放在圆底烧瓶中共热,直至反应完毕,最后发现烧瓶中还有铜片剩余,同时根据所学的知识认为还有较多硫酸剩余。
(1)铜与浓硫酸反应的化学方程式是:
可以证明有余酸的实验方案是_ (填字母)。
a.再加入适量NaNO3固体B.再滴入BaCl2溶液 C.再加入银 D.再滴入Na2CO3溶液
(2)甲同学设计求余酸浓度的实验方案是测定产生气体的量。下列方案中不可行的是 (填字母)。
a.将产生的气体缓缓通过预先称量的盛有碱石灰的干燥管,反应结束后再次称量
b.将产生的气体缓缓通入酸性高锰酸钾溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀
c.用排水法测定其产生气体的体积(折算成标准状况)
d.用排饱和NaHSO3溶液的方法测出其产生气体的体积(折算成标准状况)
(3)乙同学设计测定余酸浓度的实验方案是:测定反应后的混合液中Cu2+的量。在反应后的溶液中加入足量Na2S溶液,充分反应后,过滤、洗涤、干燥、称量沉淀的质量为W g,测得反应后溶液的体积为V mL。则剩余硫酸的物质的量浓度为 mol/L(用含W、V的代数式表示)。
(Ⅱ)丙同学探究SO2与BaCl2溶液能否反应生成白色BaSO3沉淀。
丙同学先将产生的气体通过盛有饱和NaHSO3溶液的洗气瓶,再缓缓通入BaCl2溶液中,观察到有少量白色沉淀生成,检验白色沉淀,发现沉淀全部不溶于稀盐酸,该沉淀的生成表明SO2具有 性。用一个离子方程式解释生成此沉淀的原因 。
(8分)某化学课外活动小组用海带为原料制取了少量碘水。现用CCl4从碘水中萃取碘并用分液漏斗分离两种溶液。其实验操作可分解为如下几步:
| A.把盛有溶液的分液漏斗放在铁架台的铁圈中; |
| B.把50 mL碘水和15 mL CCl4加入分液漏斗中,并盖好玻璃塞; |
| C.检验分液漏斗活塞和上口的玻璃塞是否漏液; |
| D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正; |
E.旋开活塞,用烧杯接收下层液体;
F.从分液漏斗口倒出上层水溶液;
G.将漏斗上口玻璃塞打开;
H.静置、分层。
就此实验完成下列各题:
(1)正确操作步骤的顺序是(用上述各操作的编号字母填写):________→________→________→A→G→________→E→F。
(2)上述E步骤的操作中应注意:______________________________________。
(3)上述G步骤操作的目的是:______________________________________。
(4)能用CCl4从碘水中萃取碘的原因是:______________。
某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L H2SO4溶液进行中和热的测定。
Ⅰ.配制0.50 mol/L NaOH溶液
若实验中大约要使用245 mL NaOH溶液,则至少需要称量NaOH固体________g。
Ⅱ.测定中和热的实验装置如图所示
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值57.3 kJ/mol):________。
(2)取50 mL NaOH溶液和30 mL硫酸进行实验,实验数据如下表。
①请填写下表中的空白: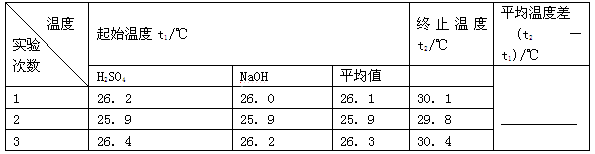
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L H2SO4溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=________(取小数点后一位)。
③上述实验结果的数值与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)________。
a.实验装置保温、隔热效果差
b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
氮化铝(AlN)是一种新型无机非金属材料。某AlN样品仅含有A12O3杂质,为测定AlN的含量,设计如下三种实验方案。(已知:A1N+NaOH+H2O=NaAlO2+NH3↑)
【方案l】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
(1)左装置图中球形干燥管的作用是。
(2)完成以下实验步骤:组装好实验装置,首先,再加入实验药品。接下来的实验操作是,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是。
(3)由于装置存在缺陷,导致测定结果偏高。请提出改进意见。
【方案2】用右上装置图测定mg样品中AlN的纯度(部分夹持装置已略去)。
(4)为测定生成气体的体积,量气装置中的X液体可以是。
a.CCl4 b.H2O c.NH4Cl溶液 d.
(5)若m g样品完全反应,测得生成气体的体积为VmL(已转换为标准状况)。则AlN的质量分数是。
【方案3】按下图步骤测定样品中A1N的纯度:
(6)步骤②生成沉淀的离子方程式为。
(7)若在步骤③中未洗涤,测定结果将(_填“偏高”、“偏低”或“无影响”)。
.海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下:
(1)海藻灼烧时是将带其放入(填仪器名称)中,用酒精灯充分加热灰化。
(2)指出提取碘的过程中有关的实验操作名称:
①②、。
(3)用CCl4从碘水中提取碘经过操作②后,有机溶剂在(填“上”或“下”)层,有机层呈色。
(4)从含碘的有机溶液中提取碘和回收有机溶剂还需经过蒸馏,
指出上图实验装置中的错误之处并改正:
①
②
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
依据上图,完成下列填空:
(1)写出电解饱和食盐水的化学方程式。
(2)如果粗盐中SO 含量较高,必须添加钡试剂除去SO
含量较高,必须添加钡试剂除去SO ,该钡试剂可以是(选填A、B、C,多选扣分)
,该钡试剂可以是(选填A、B、C,多选扣分)
A.Ba(OH)2B.Ba(NO3)2C.BaCl2
(3)判断钡试剂已经过量的方法是。
(4)为有效除去Ca2+、Mg2+、SO ,加入试剂的合理顺序为(选填A,B,C多选扣分)
,加入试剂的合理顺序为(选填A,B,C多选扣分)
A.先加NaOH溶液,后加Na2CO3溶液,再加钡试剂
B.先加NaOH溶液,后加钡试剂,再加Na2CO3溶液
C.先加钡试剂,后加NaOH溶液,再加Na2CO3溶液
(5)为检验精盐纯度,需配制150 mL0.2 mol/LNaCl(精盐)溶液,下图是该同学转移溶液的示意图,
图中的错误是。
关于该配制过程中,下列说法正确的是________。
A.应称取氯化钠晶体的质量为1.755 g
B.洗涤液不需要转移到容量瓶中
C.定容时,由于同学仰视,将导致所配溶液浓度偏低
D.摇匀后静置,发现液面低于刻度线,应继续加水至凹液面与刻度线相切