氮化铝(AlN)是一种新型无机非金属材料。某AlN样品仅含有A12O3杂质,为测定AlN的含量,设计如下三种实验方案。(已知:A1N+NaOH+H2O=NaAlO2+NH3↑)
【方案l】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
(1)左装置图中球形干燥管的作用是 。
(2)完成以下实验步骤:组装好实验装置,首先 ,再加入实验药品。接下来的实验操作是 ,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是 。
(3)由于装置存在缺陷,导致测定结果偏高。请提出改进意见 。
【方案2】用右上装置图测定mg样品中AlN的纯度(部分夹持装置已略去)。
(4)为测定生成气体的体积,量气装置中的X液体可以是 。
a.CCl4 b.H2O c.NH4Cl溶液 d.
(5)若m g样品完全反应,测得生成气体的体积为VmL(已转换为标准状况)。则AlN的质量分数是 。
【方案3】按下图步骤测定样品中A1N的纯度:
(6)步骤②生成沉淀的离子方程式为 。
(7)若在步骤③中未洗涤,测定结果将 (_填“偏高”、“偏低”或“无影响”)。
用中和滴定法测定某烧碱样品的纯度。有以下步骤:
(1)配制待测液:用5.0 g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1 L溶液。
L溶液。
(2)滴定:
①盛装0.100 0 mol·L-1盐酸标准液应该使用的滴定管是(填“甲”或“乙”)。
②向锥形瓶中加入一定体积的待测溶液,并滴入指示剂。
③滴定过程中眼睛应。

(3)计算纯度:烧碱样品的纯度是_________________。
(4)误差分析:下列操作会使测定结果偏大的有(填编号)3
①用蒸馏水润洗锥形瓶;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外;
③读取滴定管终点读数时,俯视读数;
④滴定前滴定管尖嘴有气泡,滴定后尖嘴气泡消失;
⑤取待测液的滴定管用蒸馏水洗后,未润洗。
⑴用18mol/L的硫酸配置100ml1.0mol/L的稀硫酸,若实验仪器有:
A.100ml量筒B.托盘天平 C.玻璃棒 D.50ml容量瓶
D.50ml容量瓶
E.10ml量筒 F.胶头滴管 G.50ml烧杯 H.100ml容量瓶
实验时应选用的仪器是(填入字母)。
F、E、G、C、H
⑵在容量瓶的使用方法中,下列操作不正确的是。(填写字母)
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果待配溶液是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢
加入蒸馏水到接近标线2~3cm处,用滴管滴加蒸馏水到标线
D.配制溶液时,如果试样是液体,用量筒取试样后直接倒入容量瓶中,缓慢加入蒸馏
水到接近标线2~3cm处,用滴管滴加蒸馏水到标线
E.盖好瓶塞,用食指摁住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次
甲乙两人分别用不同的方法配制100ml 3.6mol/L的稀硫酸。
(1)甲:量取20 mL18 mol/L浓硫酸,小心地倒入盛有少量水的烧杯中,搅拌均匀,待冷却至室温后转移到100 mL容量瓶中,用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶加入水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。
①实验所用的玻璃仪器除烧杯和容量瓶外,还有;
②将溶液转移到容量瓶中的正确操作是;
③定容的正确操作是
(2)乙:用100 mL量筒量取20 mL18 mol/L浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再加入水至100 mL刻度线,再搅拌均匀。你认为此法是否正确?若不正确,指出其中错误之处。
下列各组物质的分离或提纯,应选用下述方法的哪一种?(填字母即可)
| A.分液 | B.过滤 | C.萃取 | D.蒸馏 E、蒸发结晶 |
(1)除去 CaCl2溶液中悬浮的 CaCO3;
(2)从碘水中提取碘;
(3)用自来水制取蒸馏水;
(4)分离植物油和水;
(5)除去 NaCl 中所含的少量 KCl;
下图表示在没有通风橱的条件下制备氯气时的装置,图中a、b是可控制的弹簧铁夹。(已知:氯气在饱和氯化钠溶液中的溶解度较小。)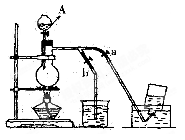
(1)仪器A的名称是;
烧杯中盛放的是;
烧瓶中发生的反应化学方程式为;
(2)在收集氯气时,应 。(填:如何操作a、b止水夹,下同),
。(填:如何操作a、b止水夹,下同),
当氯气收集完毕时应。
(3)若制得标准状况下的Cl2为0.672L,则被氧化的HCl的物质的量是