金属冶炼和处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2=4CuSO4+ 2H2O,该反应的还原剂是 ,当1mol O2发生反应时,还原剂所失电子的物质的量为 mol。向CuSO4溶液中加入镁条时有气体生成,该气体是
(3)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为
(4)某化学小组在实验中用浓硝酸和铜反应制取二氧化氮并探究二氧化氮是否能支持木炭的燃烧,其实验装置图如下: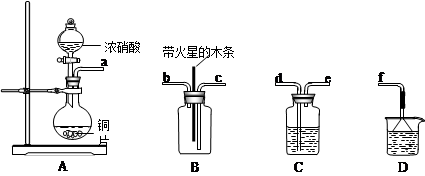
①按气流方向连接各仪器接口,顺序为a→______→______→______→______→f。
②已知二氧化氮和碳反应生成两种物质的量比为1:1的有毒气体,则该反应的化学方程式为:___________________________。
(14分)A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大.B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族.B、C、D的最高价氧化物的水化物均能互相反应生成盐和水.A和E可形成离子化合物,其晶胞结构如下图所示: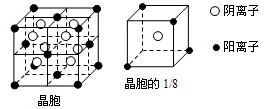
(1)A、C、D、E四种元素依次是____ ____ ____ ____ (用元素符号表示)。
(2)上述四种元素ABCD中第一电离能最小的是________电负性最大的是________其原子半径由小到大的顺序为________________(均用元素符号表示)。
(3)A和D的氢化物中,前者沸点较高,原因是________________________________。
(4)A和E的化合物晶体中,每个阳离子的周围与它最近且等距离的阳离子共有个________。
(12分)下列物质:①H2②HF ③H2O2 ④KF ⑤NH4Cl ⑥C2H2⑦N2H4+⑧BF3⑨H2O ⑩N2(填序号)
(1)只含非极性键的是___________________
(2)只含极性键的极性分子是_____________
(3)既有极性键又有非极性键的是_________
(4)只有σ键的是_______________________
(5)既有σ键又有π键的是_______________
(6)含有配位键的是_____________________
(14分)氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3。请回答下列问题:
(1)Na3N的电子式是_________________________,该化合物由________键形成。
(2)Na3N与盐酸反应生成________种盐,其电子式分别是
________________________________,________________________________。
(3)Na3N与水的反应属于________(填基本反应类型)反应。
(4)比较Na3N中两种粒子的半径:r(Na+)________ (填“>”“=”“<”) r(N3-)。
(14分)分析下图,回答以下问题: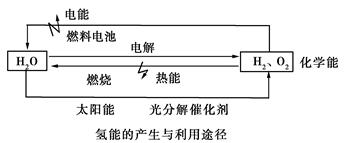
(1)水电解生成H2,首先要解决的问题是________________________________。
(2)氢气作为理想的“绿色能源”除了来源丰富,还有哪些优点:
①________________________________,②_____________________________。
(3)氢氧燃料电池是氢能源利用的一个重要方向,氢气在________极上发生________反应。若电解质溶液为KOH溶液,写出正负极上的电极反应:
正极________________________________,负极________________________________。
(10分)X、Y、Z是三种常见的短周期元素,可以形成XY2、Z2Y、XY3、Z2Y2、Z2X等化合物。已知Y的离子和Z的离子有相同的电子层结构,X离子比Y离子多1个电子层。
(1)X离子的结构示意图为________。
(2)Z2X属于________(共价或离子)化合物。
(3)Z2Y2中含有________键和________键,Z2Y2溶于水时发生反应的化学方程式是_______________。