(1)下列曲线表示卤素元素某种性质随核电荷数的变化趋势,正确的是____________。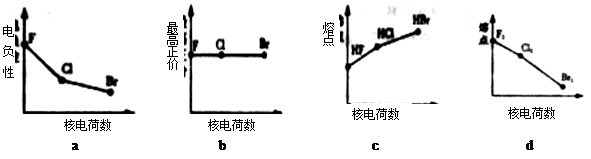
(2)利用“卤化硼法”合成含B和N两种元素的功能陶瓷,下图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为________,该功能陶瓷的化学式为___________。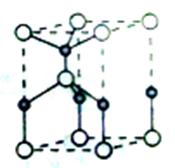
(3)BCl3和NCl3中心原子的杂化方式分别为________和_________。第一电离能介于B、N之间的第二周期元素有________种。
(4)若BCl3与XYm通过B原子与X原子间的配位健结合形成配合物,则该配合物中提供孤对电子的原子是________。
(5)SiO2是硅酸盐玻璃(Na2CaSi6O14)的主要成分,Na2CaSi6O14也可写成Na2O·CaO·6SiO2。
长石是金属铝硅盐。由钠长石化学式NaAlSi3O8可推知钙长石改写成氧化物的形式可表示为
根据下列装置图,回答有关问题: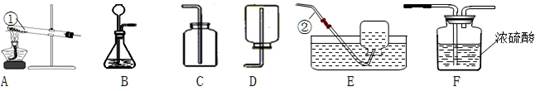
(1)写出装置图中标号仪器的名称:①;②。
(2)写出实验室用大理石和稀盐酸制取二氧化碳的化学方程式:,并据此选择上图中(填字母)组装一套制取干燥二氧化碳的装置。收集二氧化碳时,验满的方法是。
(3)如选用装置A作为制取氧气的发生装置,其化学方程式为。
⑴材料是人类赖以生存和发展的重要物质基础。
①住宅建设需大量的建筑材料,下列物质属于复合材料的是(填字母)。
a.水泥 b.PVC下水管道 c.玻璃 d.钢筋混凝土
②现代生活离不开金属材料,下列钢铁的防腐方法中,防腐效果最好,但相对费用也最贵的是(填字母)。
a.涂油漆 b.包塑料层(镀塑) c.制成不锈钢
③废品收购人员发现金属铝做的易拉罐“不生锈”,而铁生锈最厉害,便认为金属铁比铝性质活泼.你认为易拉罐“不生锈”原因是;用盐酸可除去铁尺上的铁锈(主要成分为Fe2O3),请您写出除去铁锈的化学方程式;
④废旧电池中含有汞,如果随意丢弃,会造成污染,威胁人类健康.汞的元素符号是,金属汞在常温下的状态是。常用的干电池内部填有氯化铵和等物质,在实验室分离氯化铵和二氧化锰混合物,可进行的操作是:溶解、过滤和;得到的氯化铵在农业上又可用作。
⑵2012年3月,新《环境空气质量标准》的颁布表明国家对环境问题的进一步重视。
①汽车上加装尾气催化净化装置可以使NO、CO相互反应转化为空气中含有的两种气体。名称分别为和。
②煤燃烧产生的SO2所形成的酸雨中,SO2最终转化成的酸是(填化学式)。在煤中加入适量石灰石,在氧气的共同作用下,可以与煤燃烧产生的SO2反应生成硫酸钙和二氧化碳气体,发生反应的化学方程式为。
⑶某种食品的配料标签如图所示。
①该配料中,富含蛋白质的物质是,富含油脂的物质是。
②该配料中的具有防腐作用。
③请写出检验淀粉的实验方法和现象:。
请从①活性炭②干冰③熟石灰④硝酸钾中选择适当物质,用其序号填空:
(1)可用于改良酸性土壤的是;(2)可用作复合肥料的是;
(3)能吸附水中色素和异味的是;(4)可用于人工降雨的是。
元素符号、化学式等属化学用语。以下内容请你用最合适的化学用语填
(1)地壳中含量最多的元素; (2)人体中含量最多的物质;
(3)能保持双氧水化学性质的微粒; (4)氯化铜中的阳离子;
(5)天然气主要成分;(6)锌铜干电池的负极材料;
(7)食醋中的有机酸是;(8)“佝偻病”的患者应补充的元素是。
尿素[CO(NH2)2]是首个由无机物人工合成的有机物。工业上合成尿素的反应如下:
2NH3(g)+CO2(g)  CO(NH2)2(l) + H2O (l)ΔH < 0。回答下列问题:
CO(NH2)2(l) + H2O (l)ΔH < 0。回答下列问题:
已知工业上合成尿素分两步进行,相关反应如下:
反应Ⅰ:2NH3(g)+CO2(g)  NH2COONH4(s) ΔH1< 0
NH2COONH4(s) ΔH1< 0
反应Ⅱ:NH2COONH4(s)  CO(NH2)2(l)+ H2O (l) ΔH 2> 0
CO(NH2)2(l)+ H2O (l) ΔH 2> 0
(1)下列示意图中[a表示2NH3(g)+CO2(g),b表示NH3COONH4(s),c表示CO(NH2)2(l)+H2O(l)],能正确表示尿素合成过程中能量变化曲线是(填序号)。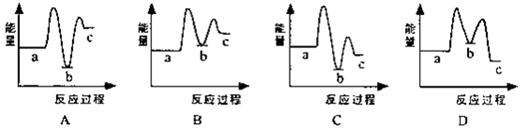
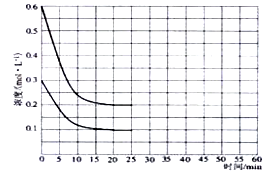
(2)某实验小组模拟工业上合成尿素的条件,在恒定温度下,将氨气和二氧化碳按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质浓度的变化曲线如下图所示。
(2)①从图中得知∆c(CO2)=0.2mol/L,则v(CO2)= ∆c(CO2)/t= 0.01mol·L-1·min-1。
①在上述条件下,从反应开始至20min时,二氧化碳的平均反应速率为。
②为提高尿素的产率,下列可以采取的措施有。
| A.缩小反应容器的容积 |
| B.升高温度 |
| C.平衡体系中及时分离出CO(NH2)2 |
| D.使用合适的催化剂 |
③该反应的平衡常数表达式K=;若升高体系的温度,容器中NH3的体积分数将
(填“增加”、“减小”或“不变”)。
④若保持平衡的温度和体积不变,25min时再向容器中充入2mol氨气和1mol二氧化碳,在40min时重新达到平衡,请在上图中画出25~50min内氨气的浓度变化曲线。