Ⅰ.下图中A、B、C分别是三种有机物的结构模型:
请回答下列问题:
(1)A及其同系物的分子式中的碳原子数用n表示。当n=_______时,烷烃开始出现同分异构体。B模型是有机物的________模型。
(2)结构简式为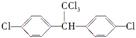 的有机物中,分子中最多有 个原子共面。
的有机物中,分子中最多有 个原子共面。
(3)等质量的A、B、C三种有机物完全燃烧生成H2O和CO2,消耗氧气的体积(相同状况下)最大的是________(填分子式)。
Ⅱ.在有机物分子中,不同氢原子的核磁共振氢谱中给出的峰值(信号)也不同,根据峰值(信号)可以确定有机物分子中氢原子的种类和数目。
(1)下列物质中,其核磁共振氢谱中给出的峰值(信号)只有一个的是________。
A.CH3COOH B.C(CH3)4 C.CH3COOCH3 D.CH3OH
(2)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如下图所示,则A的结构简式为________。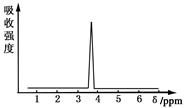
(3)用核磁共振氢谱的方法来研究C2H6O的结构,简要说明根据核磁共振氢谱的结果来确定C2H6O分子结构的方法是_______________________ _ 。
在一定体积的密闭容器中,进行如下化学反应:
CO2(g) + H2(g)  CO(g) + H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g) + H2O(g),其化学平衡常数K和温度T的关系如下表:
| T/℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应为 反应(填“吸热”、“放热”)。
(2)能使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离出CO气体
b.适当升高温度
c.增大CO2的浓度
d.选择高效催化剂
(3)能判断该反应是否达到化学平衡状态的依据是 (多选不得分)。
A.容器中压强不变
B.混合气体中 c(CO)不变
C. 正(H2)=
正(H2)= 逆(H2O)
逆(H2O)
D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
(5)若在(4)所处的温度下,在1L的密闭容器中,加入2molCO2和3molH2充分反应达平衡时,H2的物质的量为 ,CO2的物质的量为 。
A.等于1.0mol
B.大于1.0mol
C.大于0.5mol,小于1.0mol
D.无法确定
下表中的数据是破坏1 mol物质的化学键所消耗的能量:
| 物质 |
Cl2 |
Br2 |
I2 |
HCl |
HBr |
HI |
H2 |
| 能量(kJ) |
243 |
193 |
151 |
431 |
366 |
298 |
436 |
根据上述数据回答:
(1) 下列氢化物中,最不稳定的是
A.HCl B.HBr C.HI
(2)H2和Cl2反应生成HCl过程中的热效应可用下图表示,请回答下列问题: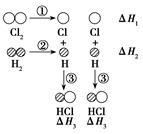
①ΔH1= kJ·mol-1,ΔH2= kJ·mol-1,ΔH3= kJ·mol-1。
②据实验测定,H2和Cl2的混合气体在光照下反应生成HCl,引发该反应的步骤是上图①~③中分子转化为原子的一步,你认为是第 (填序号)步,请说明原因: 。
③该反应的热化学方程式为 。
某同学设计了一个甲醇(CH3OH)燃料电池,并用该电池电解200mL一定浓度NaCl与CuSO4混合溶液,其装置如图1:
(1)25℃,1.01×105Pa时16g液态甲醇完全燃烧,当恢复至原状态时,放出362.9kJ热量,此反应的热化学方程式为 。
(2)写出甲中通入甲醇这一极的电极反应式 。
(3)铁电极上反应的现象为:先有红色的物质析出,后 。
石墨电极上产生的气体是 。
(4)理论上乙中两极所得气体的体积随时间变化的关系如图2所示(气体体积已换算成标准状况下的体积)原混合溶液中CuSO4的物质的量浓度 mol·L-1。(假设溶液体积不变)
空气中CO2的含量及有效利用,已经引起各国的普遍重视
Ⅰ: 目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ,△H=-49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图甲所示。
CH3OH(g)+H2O(g) ,△H=-49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图甲所示。
(1)前3min内,平均反应速率v(H2)= mol·L-1·min-1。此温度下该反应的平衡常数为 (保留两位小数,注意要写单位)。
(2)下列措施中,既能使反应加快,又能使n(CH3OH)/n(CO2)增大的是 。
A.升高温度 B.充入惰性气体
C.将H2O(g)从体系中分离 D.再充入1mol H2
(3)图乙中t5时引起平衡移动的条件是 。(填序号)
A.升高温度 B.增大反应物浓度 C.使用催化剂 D.增大体系压强
(4)反应达到平衡后,若向反应体系再加入CO2(g)、H2(g) 、CH3OH(g)、H2O(g)各1mol,化学平衡 (填“正向”、“逆向”或“不”)移动。
Ⅱ:利用CO2(g)+CH4(g) 2CO(g)+2H2(g)将CO2转化成燃料气。T℃时,在恒容密闭容器中通入物质的量均为0.1 mol的CH4与CO2,发生上述反应,吸收热量Q1kJ,测得CH4的平衡转化率与温度及压强的关系如图所示
2CO(g)+2H2(g)将CO2转化成燃料气。T℃时,在恒容密闭容器中通入物质的量均为0.1 mol的CH4与CO2,发生上述反应,吸收热量Q1kJ,测得CH4的平衡转化率与温度及压强的关系如图所示
(5)下列事实能说明该反应达到平衡的是( )
a.CO的物质的量不再发生变化
b.混合气体的密度不再发生变化
c.v正(CO2)= 2v逆(H2)
d.混合气体压强不再发生变化
e.单位时间内生成n mol CH4的同时消耗2n mol H2
(6)据图可知P1、P2、P3、P4由小到大的顺序是 。
(7)若将上述容器改为恒压容器(反应前体积相同),起始时通入物质的量均为0.1 mol的CH4与CO2,相同的温度下充分反应达到平衡后,放出热量Q2 kJ,
则Q1 Q2(填 “>”“=”或“<”)
Ⅲ: 设反应①Fe(s)+CO2(g) FeO(s)+CO(g) 和反应②Fe(s)+H2O(g)
FeO(s)+CO(g) 和反应②Fe(s)+H2O(g) FeO(s)+H2(g)的平衡常数分别为K1、K2,在不同温度下, K1、K2的值如下表所示:
FeO(s)+H2(g)的平衡常数分别为K1、K2,在不同温度下, K1、K2的值如下表所示:
| T(K) |
K1 |
K2 |
| 973 |
1.47 |
2.36 |
| 1173 |
2.15 |
1.67 |
(8)现有反应CO2(g)+H2(g) CO(g)+H2O(g),是 (填“吸”或“放”)热反应。
CO(g)+H2O(g),是 (填“吸”或“放”)热反应。
如图所示,甲、乙两池的电极材料都是铁棒与碳棒,丙池是电解精炼铜。

(1)甲池中盛有CuSO4溶液,反应一段时间后,有红色物质析出的是 棒,甲池中铁电极上电极反应式是 。
(2)乙池中盛有饱和NaCl溶液,总反应的化学方程式为 。若往乙池中滴入酚酞试液, 电极(填“Fe”或“C”)附近呈现红色。反应一段时间后,若要使溶液恢复到电解前的状态,可以向溶液中通入一定量的 。
(3)丙池中粗铜电极发生 (填“氧化”或“还原”)反应,反应过程中,Cu2+的浓度 (填“增大”、“减小”或“不变”)。