许多物质的氧化能力受溶液酸碱性的影响。高锰酸钾在不同的条件下发生的还原反应如下:
MnO4—+ 5e + 8H+ → Mn2+ + 4H2O
MnO4— + 3e + 2H2O → MnO2 + 4OH—
MnO4— + e → MnO42—(溶液呈绿色)
MnO2的还原反应可表示如下:MnO2+4H+ + 2e → Mn2++2H2O
(1)MnO2与稀盐酸不能制取氯气,其原因是 。
(2)将SO2通入KMnO4溶液中,发生还原反应的过程为______→_______
(用化学式或离子符号表示)。
(3)将PbO2投入到酸性MnSO4溶液中搅拌,溶液变为紫红色。下列叙述正确的是________(选填编号)。
a.氧化性:PbO2>KMnO4 b.还原性:PbO2> KMnO4
c.该反应可以用盐酸酸化
(4)将高锰酸钾溶液逐滴加入到硫化钾溶液中可发生如下反应,其中K2SO4和S的物质的量之比为3:2。完成并配平该反应的化学方程式。
___KMnO4+___K2S+___ _____ → ___K2MnO4 +___K2SO4 +__S↓+___ ___
反应若生成5.44 g单质硫,反应过程中转移电子的物质的量为__________。
已知2X2(g)+Y2(g) 2Z(g) △H=-a kJ·mol-1(a>0),在一个容积固定的容器中加入2molX2和1mo1Y2,在500℃对充分反应达平衡后Z的浓度为W mol·L-1,放出热量b kJ。
2Z(g) △H=-a kJ·mol-1(a>0),在一个容积固定的容器中加入2molX2和1mo1Y2,在500℃对充分反应达平衡后Z的浓度为W mol·L-1,放出热量b kJ。
(1)此反应平衡常数表达式为____________________;若将温度降低到300℃,则反应平衡常数将______________(填增大、减少或不变)。
(2)若原来容器中只加入2mol Z,500℃充分反应达平衡后,吸收热量c kJ,则Z浓度___________Wmol·L-1(填“>”、“<”或“=”),a,b、c之间满足关系___________(用代数式表示)。
(3)能说明反应已达平衡状态的是_____________________(从下列选项中选择)。
a.浓度c(Z)=2c(Y2) b.容器内压强保持不变
c.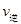 (X2)=2
(X2)=2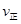 (Y2) d.容器内的密度保持不变
(Y2) d.容器内的密度保持不变
(4)若将上述容器改为恒压容器(反应器开始体积相同),相同温度下起始加入2mol X2和lmol Y2达到平衡后,Y2的转化率将___________(填“变大”、“变小”或“不变”)。
几种短周期元素的原子半径及主要化合价见下表:
分析上表的有关数据,并结合已学过知识,请用化学用语到答下列问题。
(1)写出D元素在周期表中的位置___________________。
(2)含20克F的最高价氧化物的水化物的稀溶液与足量B的氢化物的稀溶液反应放出热量a kJ,请写出该反应的热化学反应方程式____________________________。
(3)用电子式表示F2C2的形成过程______________________________。
(4)BA2能与盐酸反应得到黄绿色气体,试写出化学反应方程式:__________________,
B、C、F的最高价氧化物对应的水化物形成溶液,浓度均为0.1mol/L时,pH由大到小的顺序为___________________。
(5)lmol F2A2与水反应生成的溶液与lL 0.5mol/LEB3溶液反应的离子方程式为
______________________________。
某无色溶液中含有K+、Cl-、OH-、 、
、 ,为检验确认其中所含的各种阴离子,限用的试剂有:稀盐酸、稀硝酸、硝酸银溶液、硝酸钡溶液、澄清石灰水和酚酞试液,其中检验OH-的实验方法从略,已知检验其他阴离子的过程如下图所示:
,为检验确认其中所含的各种阴离子,限用的试剂有:稀盐酸、稀硝酸、硝酸银溶液、硝酸钡溶液、澄清石灰水和酚酞试液,其中检验OH-的实验方法从略,已知检验其他阴离子的过程如下图所示:
请你根据实验操作及现象分析完成下列各题:
(1)图中现象a、b、c表明检验出的阴离子分别是:
a_________________, b___________________,c_____________________。
(2)白色沉淀A加过量试剂②发生反应的离子方程式是:___________________。
(3)无色溶液A加试剂③的主要目的是:_____________________________________。
(4)白色沉淀A若加试剂③而不加试剂②对实验结果有无影响(选填“有影响”、“无影响"或“无法确定”)____________________________。
(5)气体B通入试剂④中发生反应的离子方程式是:____________________________。
(每一小空2分共12分)下面是一个合成反应的流程图:
(1)、写出下列物质的结构简式
| A.、 | B.、 |
| C.、 | D. . |
(2)写出下列化学反应的方程式:
③;⑤、;
某学生查阅资料得知溴乙烷的物理性质与制取方法如下表:
联想到所学溴苯的制取,他设了制取溴苯和溴乙烷的装置I,主要实验步骤如下:
①检查气密性后,向烧瓶中加入一定量的苯和液溴。
②向锥形瓶中加入乙醇和浓硫酸的混合液至恰好于进气导管口。
③将A装置中的纯铁丝向下插入混合液中。
④点燃B装置中酒精灯,用小火缓缓对锥形瓶加热10min.请填写下列空白: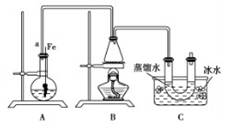
(1)A中发生反应的方程式
(2)装置长导管a的作用是
(3)C装置中的U形管内用蒸馏水封住管底的作用是
(4)反应完毕后,U形管内的现象是分离出溴乙烷时所用的最主要的仪器名称是(只填一种)