一定温度下,在2L密闭容器中NO2和O2可发生下列反应: 4NO2(g)+O2(g)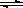 2N2O5(g)+5286 kJ已知体系中n(NO2)随时间变化如下表:
2N2O5(g)+5286 kJ已知体系中n(NO2)随时间变化如下表:
| t(s) |
0 |
500 |
1000 |
1500 |
| n(NO2)(mol) |
20 |
13.96 |
10.08 |
10.08 |
(1)能说明该反应已达到平衡状态的是 。
A.v(NO2)=4v(O2) B.容器内压强保持不变
C.v逆(N2O5)=2v正(O2) D.容器内密度保持不变
(2)反应达到平衡后,NO2的转化率为 ,此 时若再通入一定量氮气,则NO2的转化率将 (填“增大”、“减小”、“不变”)。
(3)图中能表示N2O5的浓度变化的曲线是 ,用O2表示从0~500s内该反应的平均速率v= 。
(4)能使该反应的反应速率增大,且平衡向正应方向移动的是 。
A.及时分离出NO2气体 B.适当升高温度
C.增大O2的浓度 D.选择高效催化剂
世界能源消费的90%以上依靠化学技术。
(1)工业制氢的一个重要反应是利用CO还原H2O(g)。已知:
C(石墨,s)+O2(g)═CO2(g)△H="-394k" J/mol
2C(石墨,s)+O2(g)═CO(g)△H="-222k" J/mol
H2(g)+ 1/2O2(g)═H2O(g)△H="-242k" J/mol
则CO还原H2O(g)的热化学方程式为_________________。
(2)氢能被视为最具发展潜力的绿色能源,写出碱式氢氧燃料电池的工作时的负极电极反应:_______。
(3)一种新型锂离子二次电池——磷酸铁锂(LiFePO4)电池。作为正极材料的磷酸铁锂在充、放电时的局部放大示意图如下图,写出该电池充电时的阳极电极反应__________。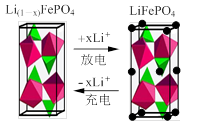
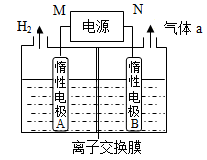
(4)LiOH是制备锂离子电池正极材料的重要原料,其电解法制备装置如上图。气体a通入淀粉KI溶液中,发现溶液变蓝,持续一段时间后,蓝色逐渐褪去。则M极为电源的________(填“正”或“负”)极,B极区电解液为_______溶液(填化学式),该离子交换膜是________(填“阳”或“阴”)离子交换膜,解释蓝色褪去的原因______________________。
一种回收并利用含碘(I-)废液的工艺流程如下: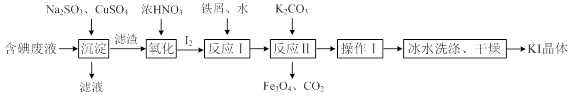
(1)“沉淀”中生成CuI的离子方程式为_______________________。
(2)CuSO4的投加量对废水中I-的去除量影响较大,不同投加量(用过量系数表示)下,反应后I-和Cu2+的浓度如图所示,则适宜的CuSO4过量系数应为_______,分析原因___________。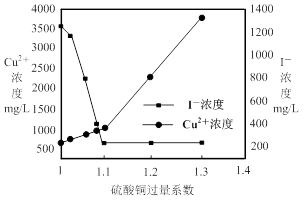
(3)反应Ⅰ中生成铁与碘的化合物(其中铁与碘的质量比为21:127),则加入的水的作用是__________,反应Ⅱ的化学方程式是_________________________。
(4)操作Ⅰ包括______,冰水洗涤的目的是_________。
对溴苯乙烯与丙烯的共聚物是一种低毒、热稳定性好的高分子阻燃剂。完成下列填空:
(1)写出该共聚物的结构简式
(2)实验室由乙苯制取对溴苯乙烯,需先经两步反应制得中间体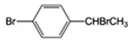
写出该两步反应所需的试剂及条件 、
(3)将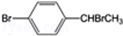 与足量氢氧化钠溶液共热得到A,A在酸性条件下遇FeCl3溶液不显色.A的结构简式为 .由上述反应可推知,由A生成对溴苯乙烯的反应条件为 .
与足量氢氧化钠溶液共热得到A,A在酸性条件下遇FeCl3溶液不显色.A的结构简式为 .由上述反应可推知,由A生成对溴苯乙烯的反应条件为 .
(4)丙烯催化二聚得到2,3﹣二甲基﹣1﹣丁烯,B与2,3﹣二甲基﹣1﹣丁烯互为同分异构体,且所有碳原子处于同一平面.写出B的结构简式
设计一条由2,3﹣二甲基﹣1﹣丁烯制备B的合成路线
(合成路线常用的表示方式为:A B…
B… 目标产物)
目标产物)
完成下列各小题。
(1)系统命名: ;
(2)写出支链只有一个乙基且式量最小的烷烃的结构简式 ;
(3)指出下列各组物质之间的关系(填写编号)
A.同种物质 B.同分异构体 C.同系物
①2-甲基戊酸与丁酸 ;
②新戊烷与2,3-二甲基丙烷 ;
③对羟基苯甲醛与甲酸苯酚酯 ;
④丙烯醇与丙酮 ;
(4)写出下列化学方程式
①丙烯加聚 ;②乙醛与银氨溶液水浴加热 ;
(5)篮烷的结构如右图所示:
①篮烷的分子式为_________________;
②篮烷不具有的性质___ _____;
a.不能溶于水 b.密度大于水
c.能与溴水发生加成反应 d.常温、常压下为气体
③蓝烷的一氯代物有________种
(1)0.6mol 的氧气与0.4mol臭氧质量之比为 ,氧原子个数之比为 ,标准状况下体积比为_____________。
(2)某元素的一种同位素原子X的质量数为a,含N个中子,它与H原子组成HmX分子,在1mol HmX中所含质子的物质的量是 mol。