重要的精细化学品M和N,常用作交联剂、涂料、杀虫剂等,合成路线如下图所示: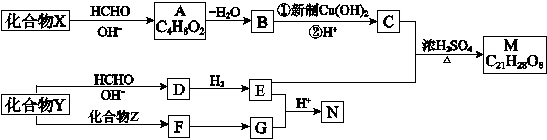
已知:
请回答下列问题:
(1)A中含氧官能团名称是 ;由A生成B的反应类型是 。
(2)X的结构简式为 。
(3)C和F在一定条件下可反应生成一种有香味的物质。写出该反应的化学方程式 。
(4)下列说法正确的是 。
a.E能发生消去反应 b.1 molM中含有4 mol酯基 c.X与Y互为同系物
(5)写出由Y生成D的化学方程式 。
(6)写出同时满足下列三个条件的F的同分异构体的结构简式 。
a.与F官能团种类和数目都相同 b.苯环上只有一个侧链 c.核磁共振H谱图中出现6或7个峰
某一反应体系中有反应物和生成物共五种物质:O2.H2CrO4.Cr(OH)3.H2O.H2O2。 已知该反应中H2O2只发生如下过程:H2O2―→O2
已知该反应中H2O2只发生如下过程:H2O2―→O2
(1)该反应中的还原剂是________。
(2)该反应中,发生还原反应的过程是________→________。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目(用单线桥法)。
__________________________________________________________________
一块表面已经氧化为氧化钠(Na2O)的金属钠的质量为9.2 g,把它投入100 g水中,在常温下放出氢气0.2 g,则金属钠的纯度为______________
某课外活动小组研究金属钾的性质。他们首先通过分析钾与钠的原子结构示意图及查阅有关资料,知道钾与钠属于同一类物质,在性质上有许多相似之处。但在金属活动性顺序表中,钾排在钠的前面,钾在空气中燃烧的产物是超氧化钾(KO2)。
完成下列问题:
(1)钾的原子核外有19个电子,画出钾的原子结构示意图_______________。
(2)预测钾的化学性质,完成下列反应的化学方程式。
①点燃钾剧烈燃烧_____________________________________________________
②将小块钾投入冷水中________________________________________________
(3)推测钾在自然界中的存在方式是____________(填“游离态”或“化合态”)
有A、B、C、D四种单质,B、C、D在常温、常压下皆为气体,A是固体。
①B单质可以在C单质中燃烧生成E,其火焰为苍白色;
②化合物E的水溶液可使紫色石蕊试液变红;
③将A在D中燃烧生成一种淡黄色固体F,若将F放水中会生成气体D。
④C能和水反应,所得溶液具有漂白作用。
试推断:
化学式A ; C ; E_________ ; F____________
(3)写出C和水反应的化学方程式
为验证干燥的Cl2没有漂白性,而Cl2与水反应后的产物具有漂白性,肖飞同学设计了如下实验。(其中a是有色布条)
⑴ A中浓硫酸的作用是 。
⑵ 实验中观察到的现象是 ,
可以得出的结论是 _____。
⑶ D装置的作用是 ,其中发生的化学反应方程式是 ______________________________________________