化学反应原理在科研和生产中有广泛应用。
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:
TaS2(s)+2I2(g) TaI4(g)+S2(g) (Ⅰ)
TaI4(g)+S2(g) (Ⅰ)
某温度反应(Ⅰ)的K=4,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为 。
(2)如下图所示,反应(Ⅰ)在石英真空管中进行,先在温度高(T2)的一端放入未提纯的TaS2粉末和少量I2(g),加热一段时间后,在另一端温度低(T1)的一端得到了纯净的TaS2晶体,则该正反应的△H 0(填“>”或“<”),上述反应体系中循环使用的物质是 。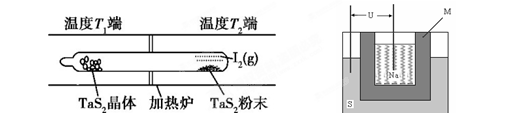
(3)上图为钠硫高能电池的结构示意图。该电池的工作温度为320℃左右,电池反应为2Na + xS=Na2Sx,正极的电极反应式为____________________________。M(由Na2O和Al2O3制得)的两个作用是________________________________________________和隔离钠与硫。
(4)写出Na2S溶液水解的离子方程式_______________________________________,Na2S溶液中c(H+)+ c(Na+)=________________。
下图是一个化学过程的示意图。
(1)请回答图中甲池是______装置,其中OH-移向________极(填“CH3OH”或“O2”)
(2)写出通入CH3OH的电极的电极反应式_________。
(3)向乙池两电极附近滴加适量紫色石蕊试液,附近变红的电极为_________极(填“A”或“B”),并写出此电极反应的电极反应式____________。
(4)乙池中反应的离子方程式为____________。
(5)当乙池中B(Ag)极的质量增加5.40g时,乙池的pH是________(若此时乙池中溶液的体积为500mL);此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是_______(填序号).
| A.MgSO4 | B.CuSO4 | C.NaCl | D.AgNO3 |
现有浓度为0.lmol/L的五种电解质溶液:①Na2CO3②NaHCO3③NaAlO2④CH3COONa⑤NaOH
已知:
(1)上述五种溶液的pH由大到小的顺序为________。(填序号)
(2)将五种溶液稀释相同的倍数时,其pH变化最大的是________。(填序号)
(3)在上述五种溶液中分别加入AlCl3溶液后,能产生无色气体的是_______:(填序号)
将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图1的装置:
(以下均假设反应过程中溶液体积不变)。
⑴铁片上的电极反应式为。
⑵铜片周围溶液会出现的现象。
⑶若2 min后测得铁片和铜片之间的质量差为1.2g,计算:
①导线中流过的电子的物质的量为mo1;
②该段时间内用硫酸铜表示的平均反应速率为
某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500 mL 0.5 mol·L-1的硫酸溶液中,右图为反应产生氢气速率与反应时间的关系图。
(1)关于图像的描述不正确的是(填序号,下同);
① o→a段不产生产生H2是室温过低,反应难以发生。
② b → c段产生H2较快可能是反应放热,温度升高,加快了反应
③ c以后,产生H2速率逐渐下降原因可能是铝片趋于消耗完全
(2)在b到c这段时间内,收集到氢气VL(标准状况),则这段时间内用硫酸表示的平均速率为mol/(L·s)(假设反应前后溶液体积不变)。
(3)其他条件不变,现换用500 mL 1 mol·L-1盐酸,产生氢气速率普遍较使用500 mL 0.5 mol·L-1硫酸的快,可能的原因是________;
(4)要加快铝与硫酸溶液制H2的反应速率,小组成员提出一系列方案,合理的有
①加入2 mol·L-1硝酸②加入少量CuSO4溶液 ③将铝片换成铝粉 ④增加硫酸的浓度至18 mol/L ⑤加CH3COONa固体; ⑥加入少量Na2SO4溶液
(5)催化剂会影响反应速率,请根据①反应写出FeCl3催化H2O2分解的另一反应原理(用离子方程式)①2Fe3++ H2O2= 2Fe2++ 2H+ +O2↑;②;
关于反应热请回答如下问题:
(1)向1L1mol/L的NaOH溶液中加入下列物质:①浓H2SO4;②稀硝酸;③稀醋酸,恰好完全反应的热效应为△H1、△H2、△H3,则三者由小到大顺序为。
(2) 实验测得,向200mL1mol/L的NaOH溶液中加入稀醋酸恰好反应放出Q kJ的热量,请写出热化学反应方程式:_________________________。
(3)已知反应CH3—CH3(g)―→CH2=CH2(g)+H2(g),有关化学键的键能如下。
| 化学键 |
C—H |
C=C |
C—C |
H—H |
| 键能/kJ·mol-1 |
414.4 |
615.3 |
347.4 |
435.3 |
试计算该反应的反应热___________________________
(4)利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:已知:N2(g)+O2(g) = 2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g)  2NH3(g)△H=-92.4kJ/mol
2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g) = 2H2O(g)△H=-483.6kJ/mol
写出氨气经催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为。