苯甲酸广泛应用于制药和化工行业。某化学小组用甲苯作主要原料制备苯甲酸,反应过程如下: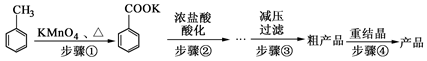
甲苯、苯甲酸钾、苯甲酸的部分物理性质见下表:
| 物质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
在水中溶解性 |
| 甲苯 |
-95 |
110.6 |
0.8669 |
难溶 |
| 苯甲酸钾 |
121.5~123.5 |
 |
 |
易溶 |
| 苯甲酸 |
122.4 |
248 |
1.2659 |
微溶 |
(1)将步骤①得到混合物加少量水,分离有机相和水相。有机相在 (填“上”或“下”)层;实验操作的名称是 。
(2)步骤②用浓盐酸酸化的目的是 。
(3)减压过滤装置所包含的仪器除减压系统外,还有 、 (填仪器名称)。
(4)已知温度越低苯甲酸的溶解度越小,但为了得到更多的苯甲酸晶体,重结晶时并非温度越低越好,理由是 。
(5)重结晶时需要趁热过滤,目的是 。
现有下列4种物质:① NH3、② NO2、③ NaCl溶液、④ Na2CO3溶液。其中,
常温下为红棕色的气体是(填序号,下同),能使湿润的红色石蕊试纸变蓝的气体是,与盐酸反应能生成气体的溶液是,加入硝酸银溶液生成白色沉淀,滴加稀硝酸沉淀不消失的溶液是。
工业上冶炼金属铁的主要反应为:Fe2O3 + xCO  2Fe + 3CO2
2Fe + 3CO2
其中该化学方程式中x的数值是, CO作(填“氧化剂”或“还原剂”)。在该反应中,若消耗了1 mol Fe2O3,则生成mol Fe。
(10分)已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):
Cu+2H2SO4(浓)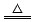 CuSO4+A↑+2H2O
CuSO4+A↑+2H2O
试通过计算和推理完成下面的问题:
(1)A物质可以导致酸雨的形成。则A应该属于______________(用字母代号填写)
a.酸 b.碱 c.盐 d.酸性氧化物 e.碱性氧化物
A物质可以使酸性KMnO4溶液褪色,此反应中__________(填写化学式,下同) 失去电子,氧化剂
是____________。
(2)一定量的铜片与100mL 18mol/L 的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,生成的A气体在标准状况下体积为_________L (假设气体全部逸出)。
(3)将反应后所得到的溶液与足量Ba(OH)2溶液充分反应。请写出此过程发生的反应的离子方程式:______________________________________________________
计算反应后所得沉淀的质量为__________________g(保留到0.1g)。
(8分)(1)已知离子反应: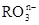 +6I—+6H+=R—+3I2+3H2O,n=_____,R元素在
+6I—+6H+=R—+3I2+3H2O,n=_____,R元素在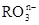 中的化合价是_____。
中的化合价是_____。
(2)化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如:
①在上述有编号的步骤中,需用还原剂的是_______,需用氧化剂的是。 (填编号)。
②标出下面化学方程式电子转移的方向和数目(用双线桥表示),并回答有关问题
Na2Cr2O7+6KI+14HCl = 2CrCl3+2NaCl+6KCl+3I2+7H2O
反应中的还原剂___________。
(6分)a、b、c、d是HCl、BaCl2、AgNO3、Na2CO3四种溶液中的一种,现将它们两两混合,现象如下表所示:
| 反应物 |
a+b |
c+d |
a+d |
a+c |
b+d |
| 现象 |
白色沉淀 |
白色沉淀 |
白色沉淀 |
白色沉淀 |
无色气体 |
(1)请用化学式填写a是、b是、c是、d是
(2)写出a+c反应的离子方程式。