下列叙述不正确的是:
| A.用反应热数据的大小判断不同反应反应速率的快慢 |
| B.用pH数据推测相同浓度的不同强酸弱碱盐在水溶液中水解程度的大小 |
| C.应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| D.用平衡常数的大小判断化学反应可能进行的程度 |
【2015广东理综化学】一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是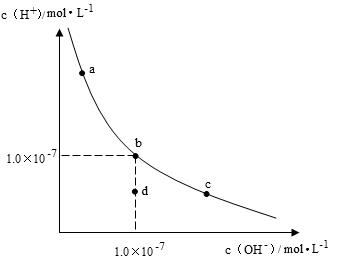
| A.升高温度,可能引起有c向b的变化 |
| B.该温度下,水的离子积常数为1.0×10-13 |
| C.该温度下,加入FeCl3可能引起由b向a的变化 |
| D.该温度下,稀释溶液可能引起由c向d的变化 |
【2015安徽理综化学】25℃时,在10mL浓度均为0.1mol/LNaOH和NH3·H2O混合溶液中,滴加0.1mol/L的盐酸,下列有关溶液中粒子浓度关系正确的是
| A.未加盐酸时:c(OH-)>c(Na+)= c(NH3·H2O) |
| B.加入10mL盐酸时:c(NH4+) +c(H+) = c(OH-) |
| C.加入盐酸至溶液pH=7时:c(Cl-) = c(Na+) |
| D.加入20mL盐酸时:c(Cl-) =c(NH4+) +c(Na+) |
【2015山东理综化学】室温下向10mL0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA溶液pH的变化曲线如图所示。下列说法正确的是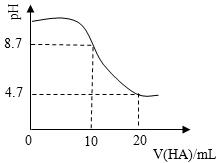
A.a点所示溶液中c(Na+)>c(A—)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,c(Na+)= c(A—)+ c(HA)
D.b点所示溶液中c(A—)> c(HA)
【2015四川理综化学】常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7。下列关于滤液中的离子浓度关系不正确的是
A. <1.0×10-7mol/L <1.0×10-7mol/L |
| B.c(Na+)= c(HCO3-)+ c(CO32-)+ c(H2CO3) |
| C.c(H+)+c(NH4+)= c(OH-)+ c(HCO3-)+2 c(CO32-) |
| D.c(Cl-)> c(NH4+)> c(HCO3-)> c(CO32-) |
【2015天津理综化学】室温下,将0.05 mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质。有关结论正确的是
| 加入的物质 |
结论 |
|
| A |
50mL 1 mol·L-1H2SO4 |
反应结束后,c(Na+)=c(SO42-) |
| B |
0.05molCaO |
溶液中 增大 增大 |
| C |
50mL H2O |
由水电离出的c(H+)·c(OH—)不变 |
| D |
0.1molNaHSO4固体 |
反应完全后,溶液pH减小,c(Na+)不变 |