食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]·3H2O。42.2 g K4[Fe(CN)6]·3H2O样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如下图所示。
试回答下列问题:
(1)试确定150 ℃时固体物质的化学式_____________。
(2)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN)。据此判断,烹饪食品时应注意的问题为_____________________________________________________。
(3)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O=2H2SO4的转化。已知,含SO2的废气通入含Fe2+、Fe3+的溶液中时,其中一个反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,则另一个反应的离子方程式为__________________________。
(4)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36。室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为3时,通过计算说明Fe3+是否沉淀完全_____________。(提示:当某离子浓度小于10-5 mol·L-1时可以认为该离子沉淀完全)
观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,回答有关问题: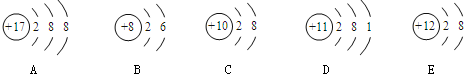
(1)属于阴离子结构示意图的是(填字母编号)。
(2)性质最稳定的原子是(填字母编号)。
(3)元素D的单质在B2中燃烧,该产物的化学式。
(4)在核电荷数1-18的元素内,列举一个与C原子的电子层结构相同的离子,写出离子的符号。
(5)写出化合物DAB在水溶液中的电离方程式。
(6分)复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1 mol·L-1的下列6种溶液的pH值:
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
C6H5ONa |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
11.3 |
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O。
依照该规律,请判断下列反应不能成立的是(填编号)。
A.CO2+H2O+2NaClO===Na2CO3+2HClO
B.CH3COOH+NaCN===CH3COONa+HCN
C.CO2 +H2O +C6H5ONa NaHCO3+C6H5OH
NaHCO3+C6H5OH
D.CO2 +H2O +2C6H5ONa Na2CO3+2C6H5OH
Na2CO3+2C6H5OH
(2)根据前述信息判断,常温下,浓度均为0.05 mol·L-1的下列5种物质的溶液中,pH最小的是(填编号),其pH值约为(填数值)。
①HCN②CH3COOH③HClO4④HClO⑤H2SO4
(10分) 高炉炼铁过程中发生的主要反应为 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)
 Fe(s)+CO2(g)
Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下:
| 温度/℃ |
1 000 |
1 150 |
1 300 |
| 平衡常数 |
4.0 |
3.7 |
3.5 |
请回答下列问题:
(1)该反应的平衡常数表达式K=____________,ΔH______0(填“>”、“<”或“=”);
(2)在一个容积为10 L的密闭容器中,1 000℃ 时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10min后达到平衡。求该时间范围内反应的平均反应速率v(CO2)=__________________、CO的平衡转化率=__________;
(3)欲提高(2)中CO的平衡转化率,可采取的措施是__________。
A.减少Fe的量
B.增加Fe2O3的量
C.移出部分CO2
D.提高反应温度
E.减小容器的容积
F.加入合适的催化剂
(22分)如下图所示,A、B、C三个装置的烧杯中分别盛有足量的CuCl2溶液。
(1)A、B、C三个装置中属于原电池的是_____________。
(2)A池中Zn是_____________极, Cu极发生_____________反应,电极反应为_____________。反应过程溶液中c(Cu2+)_____________(填“变大”“变小”或“不变”)。
(3)B池中C棒发生_________反应,电极反应为_________。B 池中的总反应为___。
(4)C池中Zn极的反应现象为 _____________。Cu极电极反应为_____________。反应过程溶液中c(Cu2+)_____________(填“变大”“变小”或“不变”)。
(6分)根据下列事实,完成相关的离子方程式或电离方程式
(1)Na2S溶液使酚酞显红色
(2)硫酸铝钾[明矾KAl(SO4)2·12H2O]可以作净水剂
(3)常温下,磷酸(H3PO4)溶液pH﹤7