Fe2O3具有广泛的用途。甲同学阅读有关资料得知:在高温下煅烧FeCO3可以得到Fe2O3。为了进一步验证此结论,他做了如下实验:
| 实验步骤 |
实验操作 |
| Ⅰ |
取一定质量的FeCO3固体置于坩埚中,高温煅烧至质量不再减轻,冷却至室温 |
| Ⅱ |
取少量实验步骤I所得固体放于一洁净的试管中,用足量的稀硫酸溶解 |
| Ⅲ |
向实验步骤Ⅱ所得溶液中滴加KSCN溶液,溶液变红 |
由此甲同学得出结论:4FeCO3+O2 2Fe2O3+4CO2
2Fe2O3+4CO2
(1)写出实验步骤Ⅲ中发生反应的离子方程式__________________________________。
(2)乙同学提出了不同的看法:煅烧产物可能是Fe3O4,因为Fe3O4也可以溶于硫酸,且所得溶液中也含有Fe3+。于是乙同学对甲同学的实验步骤Ⅲ进行了补充改进:检验实验步骤Ⅱ所得溶液中是否含有Fe2+。他需要选择的试剂是____________(填序号)。
a.氯水 b.氯水+KSCN溶液 c.K3[Fe(CN)6](铁氰化钾溶液)
(3)丙同学认为即使得到了乙同学预期的实验现象,也不能确定煅烧产物的成分。你认为丙同学持此看法的理由是____________。
(4)丙同学进一步查阅资料得知,煅烧FeCO3的产物中的确含有+2价铁元素。于是他设计了另一种由FeCO3制取Fe2O3的方法:先向FeCO3中依次加入试剂:稀硫酸、________ (填试剂名称)和氨水;再_________(填操作名称),灼烧,即可得到Fe2O3。
(5)工业上用氧化还原滴定法测菱铁矿中FeCO3的质量分数,通过控制样品的质量,使滴定时消耗KMnO4溶液体积为c mL,对应菱铁矿中FeCO3的质量分数为c%,可以简化计算。某同学取含FeCO3 c%的菱铁矿a g,用足量稀硫酸溶解后,再用0.0 200 mol·L-1的酸性KMnO4溶液滴定(KMnO4被还原成Mn2+),最终消耗KMnO4溶液c mL。假定矿石中无其他还原性物质,则所取菱铁矿的质量a=__________g。(FeCO3的摩尔质量为116 g·mol-1)
(16分)氮及其化合物在工农业生产中具有重要作用,人工固氮是指将氮元素由游离态转化为化合态的过程。
(1)最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实验氮的固定一电解法合成氨,大大提高了氮气和氢气的转化率。总反应式为:N2(g)+3H2(g)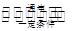 2NH3(g),则在电解法合成氨的过程中,应将H2不断地通入_________极(填“阴”或“阳”;向另一电极通入N2,该电极的反应式为__________________________。
2NH3(g),则在电解法合成氨的过程中,应将H2不断地通入_________极(填“阴”或“阳”;向另一电极通入N2,该电极的反应式为__________________________。
(2)目前工业合成氨的原理是:N2(g)+3H2(g) 2NH3(g)△H=-93.0kJ/mol。某小组进行工业合成氨的模拟研究,在1L密闭容器中,分别加入0.1mol N2和0.3mol H2。实验①、②、③中c(N2)随时间(t)的变化如图所示。
2NH3(g)△H=-93.0kJ/mol。某小组进行工业合成氨的模拟研究,在1L密闭容器中,分别加入0.1mol N2和0.3mol H2。实验①、②、③中c(N2)随时间(t)的变化如图所示。
实验②从开始到达到平衡状态的过程中,用H2表示的平均反应速率为 。与实验①相比,实验②所采用的实验条件可能为 (填字母),实验③所采用的实验条件可能为 (填字母)。
a.增大压强
b.减小压强
c.升高温度
d.降低温度
e.使用催化剂
(3)NCl3遇水发生水解反应,生成NH3的同时得到 (填化学式)。ClO2是广谱高效消毒剂,制备原理为NCl3+6ClO2-+3H2O=NH3↑+6ClO2+3OH-+3Cl-。若制取27g ClO2,则反应中转移电子的物质的量是 。
(4)25℃时,将amol·L-1的氨水与bmol·L-1盐酸等体积混合,反应后溶液恰好显中性,则a b(填“>”、“<”或“=”)。用a、b表示NH3·H2O的电离平衡常数为 。
(16分) 苹果酸是饮料苹果醋的成分之一。合成聚苹果酸的流程如下: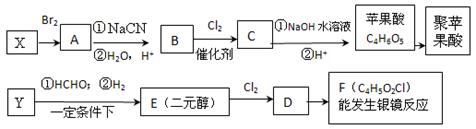
已知:①0.1mol苹果酸与足量碳酸氢钠溶液反应能产生4.48L二氧化碳(标准状况下);
②苹果酸脱水能生成使溴水褪色的产物;
③RC≡CH+HCHO RC≡C-CH2OH;
RC≡C-CH2OH;
④RCH2Br RCH2COOH;
RCH2COOH;
⑤X、Y都是烃,在核磁共振氢谱图上都只有1个峰。
请回答下列问题:
(1)A的名称是__________;C分子中的含氧官能团名称是___________________;
(2)E的结构简式是______________________;
(3)由F制苹果酸可能发生的有机反应类型为___________________;
(4)下列关于苹果酸的说法中不正确的是________;
| A.苹果酸中能发生酯化反应的官能团有2种 |
| B.1mol苹果酸可与3mol NaOH发生中和反应 |
| C.1mol苹果酸与足量金属Na反应生成1mol H2 |
| D.与苹果酸具有相同官能团的同分异构体有2种 |
(5)写出下列反应的化学方程式:
①苹果酸制备聚苹果酸:___________________________________;
②D生成F:_____________________________________________;
(6)B的同分异构体中符合以下条件的有________种。
a.能发生银镜反应;
b.能与碳酸氢钠溶液反应;
c.分子中不存在
化学-有机化学基础(13分)
G是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成
已知:Ⅰ、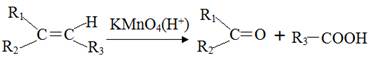
Ⅱ、F变成G相当于在F分子中去掉1个X分子。请回答下列问题:
(1)有机物A的化学名称为___________;由B生成C的反应类型为____________。
(2)E分子中的官能团名称为______________;X催化氧化可生成一种常温下为气体的物质,写出该气体分子的结构式_____________。
(3)下列关于G的说法正确的是 (填序号)。
a.属于芳香族化合物 b.1molG与氢气反应最多消耗5mol氢气
c.遇氯化铁溶液显紫色 d.该有机物的分子式为C9H6O3
(4)写出F与足量的NaOH溶液反应的化学方程式_______________________。
(5)含酯基且遇FeCl3溶液显紫色,与D互为同分异构体的有机物有________种,写出其中苯环上的一卤代物只有2种的同分异构体的结构简式______________。
【化学-物质结构与性质】(13分)
物质结构理论有助于人们理解物质变化的本质,进行分子设计和研究反应规律。请回答下列问题:
(1)已知硒是一种非金属,可以用作光敏材料、电解锰行业催化剂。
①Se是元素周期表中第34号元素,其基态原子的核外电子排布式为_________。
②根据价层电子对互斥理论,可以推知SeO3的分子空间构型为_________,其中Se原子采用的轨道杂化形式为__________。
③CSe2首次是由H2Se与CCl4反应后制取的,已知CSe2与CO2结构相似,则CSe2分子内σ键与π键个数之比为________。
(2)金属铜广泛地应用于电气、机械制造、国防等领域。
①CuO受热易分解为Cu2O和O2,请从铜的原子结构来说明CuO受热易分解的原因:____________。
②向氯化铜溶液中加入过量浓氨水,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]Cl2晶体。上述深蓝色晶体中含有的化学键除普通共价键外,还有________和_____________。
(3)硼元素B在化学中有很重要的地位。硼的化合物在农业、医院、玻璃等方面用途很广。
①立方氮化硼可利用人工方法在高温高压条件下合成,属于超硬材料,同属原子晶体的氮化硼(BN)比晶体硅具有更高硬度和耐热性的原因是_______________________。
②科学家发现硼化镁在39K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列。如图是该晶体微观窨中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。根据图示确定硼化镁的化学式为_________。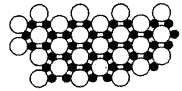
硫酸亚锡(SnSO4)是一种重要的能溶于水的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下: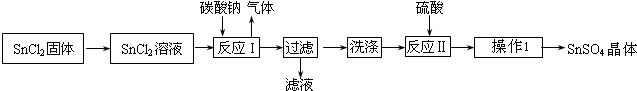
查阅资料:
I.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnC12易水解生成碱式氯化亚锡[Sn(OH)Cl]。
回答下列问题:
(1)操作l的步骤为 ____、____、过滤、洗涤、干燥。对沉淀进行洗涤的方法是_____________。
(2)SnCl2粉末需加浓盐酸进行溶解,请结合必要的化学方程式用平衡移动原理解释原因:________。
(3)反应I得到沉淀是SnO,该反应的离子方程式是__________。
(4)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是:________________。
(5)该小组通过下列方法测定所制备的SnSO4固体的纯度(杂质不参与反应):
①取ag SnSO4固体溶于稀硫酸配制成100mL 溶液。
②取25.00mL溶液,向溶液中加入过量的FeCl3固体;
③再用cmol/L的K2Cr2O7标准溶液进行滴定(已知酸性环境下,Cr2O72-可被还原为Cr3+),达终点时记录消耗K2Cr2O7标准溶液的体积。
④重复进行②、③两步操作,测定消耗K2Cr2O7标准溶液的平均体积为VmL。
则SnSO4固体的纯度是________________。(用含a、c、V的代数式表示)