化学-有机化学基础(13分)
G是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成

已知:Ⅰ、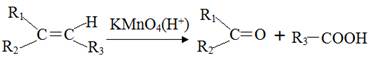
Ⅱ、F变成G相当于在F分子中去掉1个X分子。请回答下列问题:
(1)有机物A的化学名称为___________;由B生成C的反应类型为____________。
(2)E分子中的官能团名称为______________;X催化氧化可生成一种常温下为气体的物质,写出该气体分子的结构式_____________。
(3)下列关于G的说法正确的是 (填序号)。
a.属于芳香族化合物 b.1molG与氢气反应最多消耗5mol氢气
c.遇氯化铁溶液显紫色 d.该有机物的分子式为C9H6O3
(4)写出F与足量的NaOH溶液反应的化学方程式_______________________。
(5)含酯基且遇FeCl3溶液显紫色,与D互为同分异构体的有机物有________种,写出其中苯环上的一卤代物只有2种的同分异构体的结构简式______________。
甲醇是一种可再生能源,在日常生活中有着广泛的应用.工业上用CO生产燃料甲醇,如:CO(g)+2H2(g)⇌CH3OH(g).图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化.
请回答下列问题:
(1)图1表示使用和未使用催化剂时反应过程和能量的对应关系.下列有关催化剂的说法不正确是
| A.降低分子的能量 | B.增加了活化分子数 |
| C.提高了活化分子百分数 | D.增加了单位体积内的活化分子数 |
(2)从反应开始到建立平衡,该过程中释放 kJ热量.
(3)在T2℃下,将2molCO和6molH2充入2L的密闭容器中,达到平衡状态时,测得c(CO)=0.2mol•L﹣1,则CO的转化率为 .
(4)如图3为常用笔记本电脑所用甲醇质子交换膜燃料电池的结构示意图如.电池总反应为2CH3OH+3O2⇌2CO2+4H2O.在电脑的使用过程中,电池的温度往往因为各种原因会升高.温度升高_____________(填:“有利于”或“不利于”)电池将化学能转化为电能.该装置中___________(填:“a”或“b”)为电池的负极,该电极反应式为 .
氯元素是生产生活中常见的非金属元素。
(1)将Cl2通入NaOH溶液中得到以NaClO为有效成分的漂白液,写出该反应的离子方程式 ;不直接用Cl2作漂白剂的原因是 (写出两条)。
(2)使用Cl2为自来水消毒时,会与水中的有机物生成对人体有害的有机氯化物。下列物质中可以替代Cl2为自来水杀菌消毒的是 (填字母序号)。
a.臭氧 b.NH3 c.明矾 d.ClO2
(3)生物质混煤燃烧是当今能源燃烧利用的最佳方式之一,但生物质中氯含量较多,燃烧过程中会形成金属氯化物(如NaCl)和Cl2等物质,对金属炉壁造成腐蚀。
①NaCl和Cl2中化学键的类型分别是 和 。
②燃煤过程中生成的SO2会与NaCl等物质发生反应,生成硫酸盐和Cl2。若生成Cl2 22.4 L(标况)时转移电子数为4×6.02×1023,该反应的化学方程式是 。
③已知:2H2O2(l)=2H2O(l)+O2(g) ΔH1 = -196.46 kJ·mol-1
H2(g)+1/2O2(g)= H2O(l) ΔH2 = -285.84 kJ·mol-1
Cl2(g)+H2(g)=2HCl(g) ΔH3 = -184.60 kJ·mol-1
在催化剂作用下,用H2O2(l)可除去上述燃烧过程中产生的Cl2。依据上述已知反应,写出该反应的热化学方程式: 。
在如图所示的量热计中,将100mL0.50mol·L CH3COOH溶液 与100mL0.55mol·L-1NaOH溶液混合.已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J·℃-1,生成溶液的比热容为4.184J·g-1·℃-1,溶液的密度均近似为1g·mL-1.实验中某同学计算中和热,记录数据如下:
| 实验序号 |
起始温度t1/℃ |
终止温度t2/℃ |
|
| 醋酸溶液 |
氢氧化钠溶液 |
混合溶液 |
|
| 1 |
25.0 |
25.1 |
27.8 |
| 2 |
25.1 |
25.3 |
27.9 |
| 3 |
25.2 |
25.5 |
28.0 |
(1)试求CH3COOH的中和热△H 。
(2)CH3COOH的中和热的文献值为56.1KJ·mol-1,则请你分析在(1)中测得的实验值偏差可能的原因 。
(3)实验中NaOH过量的目的是 。
(4)CH3COOH的中和热与盐酸的中和热绝对值相比, 的较大,原因是 。
A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同。(已知:2NO2(g)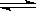 N2O4(g) ΔH<0)
N2O4(g) ΔH<0)
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是vA__________vB(填“>”、“<”或“=”);若打开活塞K2,气球B将__________(填“变大”、“变小”或“不变”)。
(2)关闭活塞K2,若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率αA将____________(填“增大”、“减小”或“不变”);若分别通入等量的氖气,则达到平衡时,A中NO2的转化率将____________,B中NO2的转化率将__________(填“变大”、“变小”或“不变”)。
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,__________中的颜色较深。
某化学反应2A(g)  B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
| 实验序号 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
| 1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
800℃ |
c2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
| 3 |
800℃ |
c3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
| 4 |
820℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为____________mol/(L·min)。
(2)在实验2,A的初始浓度c2=____________mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3 v1(填>、=、<),且c3_______1.0 mol/L(填>、=、<)。
(4)比较实验4和实验1,可推测该反应是________反应(选填吸热、放热)。