我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。
I.已知反应 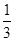 Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g)
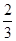 Fe(s)+ CO2(g) ΔH=-23.5 kJ·mol-1,该反应在
Fe(s)+ CO2(g) ΔH=-23.5 kJ·mol-1,该反应在
1000℃的平衡常数等于4。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1. 0mol,反应经过l0min后达到平衡。
(1)CO的平衡转化率=____________
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________
a.提高反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅱ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+ 2H2(g) CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题:
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=________
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
| 容器 |
反应物投入的量 |
反应物的 转化率 |
CH3OH的浓度 |
能量变化 (Q1、Q2、Q3均大于0) |
| 甲 |
1mol CO和2mol H2 |
α1 |
c1 |
放出Q1kJ热量 |
| 乙 |
1mol CH3OH |
α2 |
c2 |
吸收Q2kJ热量 |
| 丙 |
2mol CO和4mol H2 |
α3 |
c3 |
放出Q3kJ热量 |
则下列关系正确的是________
A.c1=c2 B.2Q1=Q3 C.2α1=α3 D.α1+α2 =1
E.该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量
Ⅲ.以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题: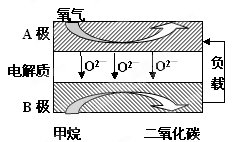
(1)B极上的电极反应式为
(2)若用该燃料电池做电源,用石墨做电极电解100mL 1mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为 (标况下)。
原子序数依次增大的短周期元素a、b、c、d和e中,a的最外层电子数为其周期数的二倍;b和d的A2B型氢化物均为V型分子,c的+1价离子比e的﹣1价离子少8个电子.
回答下列问题:
(1)元素a为 ,c为 ;
(2)由这些元素形成的双原子分子为 ;
(3)由这些元素形成的三原子分子中,分子的空间结构属于直线型的是 ,非直线型的是 (写两种);
(4)这些元素的单质或由它们形成的AB型化合物中,其晶体类型属于原子晶体的是 ,离子晶体的是 ,金属晶体的是 ,分子晶体的是 ;(每空填一种)
(5)元素a和b形成的一种化合物与c和d形成的一种化合物发生的反应常用于防毒面具,该反应的化学方程式为 .
元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是 。
a.原子序数和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水合物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为 ,氧化性最弱的简单阳离子是 。
(3)已知:
| 化合物 |
MgO |
Al2O3 |
MgCl2 |
AlCl3 |
| 类型 |
离子化合物 |
离子化合物 |
离子化合物 |
共价化合物 |
| 熔点/℃ |
2800 |
2050 |
714 |
191 |
工业制镁时,电解MgCl2而不电解MgO的原因是 ;
制铝时,电解Al2O3而不电解AlCl3的原因是 。
(4)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:
写出SiCl4的电子式: ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式: 。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是 。
a.NH3b.HIc.SO2d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式: 。
A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B 在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1)A在周期表中的位置是 ,写出一种工业制备单质F的离子方程式 。
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为 ,其水溶液与F单质反应的化学方程式为 ;在产物中加入少量KI,反应后加人CC14并振荡,有机层显 色。
(3)由这些元素组成的物质,其组成和结构信息如下表:
| 物质 |
组成和结构信息 |
| a |
含有A的二元离子化合物 |
| b |
含有非极性共价键的二元离子化合物,且原子数之比为1:1 |
| c |
化学组成为BDF2 |
| d |
只存在一种类型作用力且可导电的单质晶体 |
a的化学式为 ;b的化学式为 ;c的电子式为 ;
d的晶体类型是 。
(4)由A和B、D元素组成的两种二元化合物形成一类新能源物质。一种化合物分子通过 键构成具有空腔的固体;另一种化合物(沼气的主要成分)分子进入该空腔,其分子的空间结构为 。
元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子结构示意图为 。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是 (填序号)。
a.Cl2、Br2、I2的熔点
b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性
d.HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液 NaClO3溶液
NaClO3溶液 KClO3晶体
KClO3晶体
①完成I中反应的总化学方程式:□NaCl+□H2O=□NaClO3+□ 。
②Ⅱ中转化的基本反应类型是 ,该反应过程能析出KClO3晶体而无其它晶体析出的原因是 。
(4)一定条件,在水溶液中1 mol Cl-、ClO-(x=1,2,3,4)的能量(KJ)相对大小如图所示。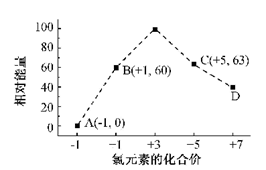
①D是 (填离子符号)。
②B→A+C反应的热化学方程式为 (用离子符号表示)。
4种相邻的主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性。回答下列问题:
| m |
n |
||
| x |
y |
(1)元素x在周期表中的位置是第_____周期、第____族,其单质可采用电解熔融的_____方法制备。
(2)m、n、y三种元素最高价氧化物的水化物中,酸性最强的是______,碱性最强的是______.(填化学式)
(3)气体分子(mn)2的电子式为_______,(mn)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是_____________________________。