元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子结构示意图为 。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是 (填序号)。
a.Cl2、Br2、I2的熔点
b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性
d.HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液 NaClO3溶液
NaClO3溶液 KClO3晶体
KClO3晶体
①完成I中反应的总化学方程式:□NaCl+□H2O=□NaClO3+□ 。
②Ⅱ中转化的基本反应类型是 ,该反应过程能析出KClO3晶体而无其它晶体析出的原因是 。
(4)一定条件,在水溶液中1 mol Cl-、ClO-(x=1,2,3,4)的能量(KJ)相对大小如图所示。
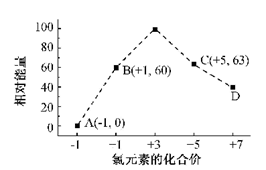
①D是 (填离子符号)。
②B→A+C反应的热化学方程式为 (用离子符号表示)。
共有下列各组微粒或物质:
| A.O2和O3 | B. C和 C和 C C |
C. |
D.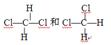 E、 E、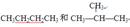 |
(1)组两种微粒互为同位素;(2)组两种物质互为同素异形体;
(3) 组两种物质属于同系物;(4)组两物质互为同分异构体;
(5)组两物质是同一物质。
(1)下列操作错误的是_________(填序号)
A. 用蒸发皿进行加热蒸发实验时,不垫石棉网。
B. 浓硫酸不慎沾到皮肤上,迅速用NaOH溶液清洗,再用水洗。
C. 闻气体气味时,用手在容器口轻轻扇动,使少量气体飘入鼻孔中。
D. 使用分液漏斗和容量瓶时,首先检查是否漏液。
E.做实验时,剩余试剂一律不能放回原试剂瓶。
(2) 最近媒体报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(有效成分是NaClO)发生氯气中毒的事件。根据你所学的氧化还原反应知识,用离子方程式表示产生氯气的原因:。
(3) 已知向四羟基铝酸钠溶液中加入稀盐酸有氢氧化铝生成。某同学根据所学知识,提出不能使用该方法制取A1(OH)3,理由为。(用离子方程式表示)
请你另举出一种用氯化铝溶液制取A1(OH)3的合理方法,该反应的离子方程式为。
(4)据有关报道。目前已能冶炼出纯度高达99.9999%的铁,下列关于纯铁的叙述中,正确的是(填字母)。
A.硬度比钢小,熔点比钢高B.不能与盐酸反应
C.与不锈钢成分相同 D.在冷的浓硫酸中钝化
(5)向沸水中逐滴滴加饱和FeCl3溶液,至液体呈透明的红褐色时停止加热,所得分散系的分散质大小范围是。
(6)合成氨工业生产中常用铁触媒做催化剂,其主要成分是FeO、Fe2O3。已知某铁触媒中,铁、氧离子的物质的量之比为4∶5,其中Fe2+与Fe3+物质的量之比为。
芳香族化合物A只有两个对位取代基,在一定条件下有如下图所示转化关系。其中,1 mol C与Na完全反应生成1 mol H2,若l mol C与NaHCO3完全反应,也产生l mol气体,E可以使溴的四氯化碳溶液褪色。
(1)D分子中的含氧官能团名称是___________,A的结构简式是___________。
(2)反应④的基本类型是_______反应,反应⑤的化学方程式是___________________________ 。
(3)与C取代基位置相同,既能与FeCl3溶液显色、又能发生水解反应的结构简式为: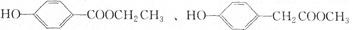 ,___________、___________。(写两种即可)
,___________、___________。(写两种即可)
(4)现有C和E的混合物n mol。在空气中完全燃烧消耗O2___________L(标准状况),若生成CO2 a L(标准状况)、H2O b g,则C、E混合物中含E的物质的量的计算式为:______________________ 。
植物精油具有抗菌消炎、解热镇痛等药物功用。从樟科植物枝叶中提取的精油中含有下列甲、乙、丙三种成分: 丙:分子式C16H14O2
丙:分子式C16H14O2
(1)甲、乙中含氧官能团的名称分别为___________ 、___________。
(2)经下列过程甲可转化为乙:
①,②的反应类型分别为___________、___________ 。
(3)通过下列合成路线由乙可得到丙(部分反应产物略去)
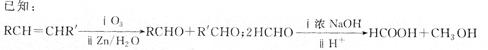
①F的结构简式为_________________________________________________________________。
②由乙制取D的化学方程式_______________________________________________________。
③写出同时符合下列要求的D的同分异构体的结构简式______________________。
a.化合物是二取代苯
b,分子中有5种不同环境的氢原子,其个数比为1:2:2:1: 2
c.能使溴的CCl4溶液褪色,且在酸性条件下可以发生水解反应
④丙的结构简式为_________________。
已知:

有机物E和F可用作塑料增塑剂或涂料的溶剂,它们的相对分子质量相等,可以用下列方法合成。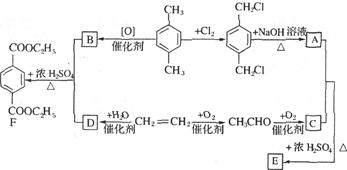
(1)写出有机物的名称: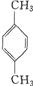 ,
,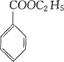 。
。
(2)写出下列反应的化学方程式。
①A+C→E。
②CH2=CH2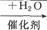 D。
D。
(3)E和F的相互关系是。
| A.同一种物质 | B.同素异形体 | C.同系物 | D.同分异构体 |