碳族元素是形成化合物种类最多的元素。
(1)碳原子2个2p电子的运动状态不相同的方面是_______;C5HxN分子中C、N原于最外层都达到8电子稳定结构,则x的值可能为_______ (选填序号)。
a.10 b.11 c.13 d.15
(2)如图是金刚石晶体的结构示意图。则关于金刚石的描述正确的是 (选填序号)。
a.C-C键键角都为109°28’ b.最小的环由6个C原子构成
c.可溶于非极性溶剂 d.l mol金刚石含有4 mol C-C键
(3)以下比较错误的是________(选填序号)。
a.稳定性SiH4>CH4 b.沸点SiH4>CH4
c.熔点SiC>Si d.键能C=C>C-C
(4)NaBH4是广泛使用的有机反应还原剂,其中H为-1价,SiO2为其制备原料之一。
①配平以下制备NaBH4的化学方程式:□Na2B4O7+□Na+□SiO2+□H2→□NaBH4+□Na2SiO3
②反应中被还原的元素为________。
(5)碳酸钙是石灰石、方解石等的主要成分,可以形成“喀斯特”地貌、钟乳和石笋,有关反应的化学方程式为_________________________________________。
(6)若物质组成相似,可相互推算组成元素的相对原子质量。某学习小组模拟求算锗的相对原子质量,测得了锗酸钠中Na和Ge的质量分数、硅酸钠中Na和Si的质量分数,他们还需查阅的数据是______(选填序号)。
a.氧元素的相对原子质量
b.硅元素的相对原子质量
c.钠元素的相对原子质量
某同学想探究硫和碳原子的得电子能力的强弱,通过比较它们最高价氧化物对应水化物的酸性强弱来验证,设计了如图实验,请回答: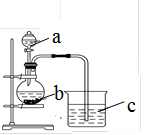
(1)仪器a的名称是,
应盛放下列药品中的(填序号)。
A.稀硫酸 B. 亚硫酸 C. 氢硫酸 D. 盐酸
(2)仪器b应盛放下列药品中的(填序号)。
A.碳酸钙 B. 硫酸钠 C. 氯化钠 D. 碳酸钠
(3)b中反应的离子方程式为。
若看到仪器C中的现象是,即可证明 比酸性强(填化学式),得电子的能力比强。
(1)下列五种物质中①Ar、②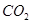 、③
、③ 、④NaOH、⑤
、④NaOH、⑤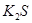 ,只存在共价键的是(填序号,下同),只存在离子键的是,既存在离子键又存在共价键的是,不存在化学键的是。
,只存在共价键的是(填序号,下同),只存在离子键的是,既存在离子键又存在共价键的是,不存在化学键的是。
(2)在以下过程中:①碘的升华、②烧碱熔化、③氯化铵受热分解、④石英熔化、⑤氯化钠溶于水、⑥氯化氢溶于水、⑦氧化钠溶于水、⑧碘溶于四氯化碳,未发生化学键破坏的是
(填序号,下同),仅发生离子键破坏的是,仅发生共价键破坏的是,既发生离子键破坏、又发生共价键破坏的是。
A、B、C、C、E是含有一种相同元素的五种物质,可发生如下转化关系:其中A是一种淡黄色粉末固体单质;B是气态氢化物;C、D是氧化物;E是该元素最高价氧化物对应的水化物。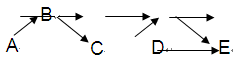
(1)元素A在元素周期表中的位置为。
(2)B的名称是。
(3)写出C的一种用途;
C的水溶液在空气中放置一段时间后溶液的pH减少,试说明其原因
。
(4)D溶于水发生反应的离子方程式。
(5)E的浓溶液与碳单质反应的化学方程式。
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
(1)④的最简单氢化物的电子式为,结构式。
(2)③、⑦、⑧的最高价含氧对应的水化物的酸性最强的是(填化学式)。
(3)④、⑥、⑦的原子半径由小到大的顺序为。
(4)由①、②、③、④四种元素可形成多种既含有离子键又含有共价键的化合物,写出其中一种化合物的化学式。
(5)元素③和元素⑧的氢化物极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,互相靠近时,可看到大量的白烟,写出产生该现象的化学方程式是。
(6)用电子式表示②的最高价氧化物的形成过程:。(7)研究表明:②的最高价氧化物在一定条件下可被还原为晶莹透明的晶体X,其结构中原子的排列为正四面体,请写出X及其同素异形体的名称、。
将51.2 g铜恰好完全溶于V mL 10 mol/L硝酸中得到硝酸铜溶液,收集到氮的氧化物(含NO、NO2、N2O4)的混合物共17.92 L(标准状况),这些气体恰好能被500 mL
2.0 mol/L NaOH溶液完全吸收,得到500 mL(假设吸收气体后溶液体积不变)钠盐溶液。
发生的反应有: N2O4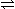 2NO2
2NO2
NO+NO2+2NaOH=2NaNO2+H2O
2NO2+2NaOH=NaNO2+NaNO3+H2O
通过计算回答下列问题:
(1)硝酸铜溶液中硝酸铜的物质的量为________________,V=________。
(2)上述钠盐溶液中硝酸钠的物质的量浓度为______________________。
(3)向上述硝酸铜溶液中加入足量的稀硫酸,再加入足量铜粉,有W g铜完全溶解,将收集到的气体(只有NO生成)全部收集于一试管中,并将充满该气体的试管倒立于盛水的水槽里,再向试管里充入一定量的氧气,最终恰好使溶液充满试管。
①W=______________。②通入的氧气在标况下的体积为______________。