实验室用图I所示的装置制取干燥的氨气。
(1)A处反应的化学方程式为 。
(2)为收集到干燥的氨气,导管C应接 (填序号)。
(3)装置B中盛装的试剂的名称是 。
(4)在水槽中加入水(含酚酞),将充满氨气的试管倒置于放入水槽中(如图Ⅱ所示),将拇指稍移开试管口,可观察到的现象为_______________ 。
(5)在D、E、F三种气体收集方法中,能用于收集NO的是________(填写序号)。
食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。已知:氧化性:IO3->Fe3+>I2;还原性:S2O32->I-
3I2+6OH-=5I-+IO3-+3H2O KI+I2 KI3
KI3
(1)某学习小组对加碘盐进行了如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得试液分为3份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①加KSCN溶液显红色,该红色物质是 (用化学式表示);CCl4中显紫红色的物质是 。
②第二份试液中加入足量KI固体后,反应的离子方程式为 、 。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。写出潮湿环境中KI与氧气反应的化学方程式: 。
将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适? (填“是”或“否”),并说明理由: 。
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是 。
| A.Na2S2O3 | B.AlCl3 | C.Na2CO3 | D.NaNO2 |
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂。请设计实验方案,检验该加碘盐中的Fe2+: 。
0.80gCuSO4•5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.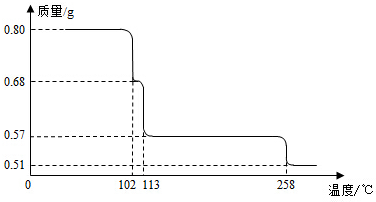
请回答下列问题:
(1)试确定200℃时固体物质的化学式___________________(要求写出推断过程);
(2)取270℃所得样品,于570℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为______________________________。把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为_________________,其存在的最高温度是__________;
(3)上述氧化性气体与水反应生成一种化合物,该化合物的浓溶液与Cu在加热时发生反应的化学方程式为____________________________________________;
(4)若在0.1mol•L-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是__________________mol•L-1(溶液体积变化可忽略不计)。
由熔盐电解法获得的粗铝含有一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于刚才镀铝。工艺流程如下: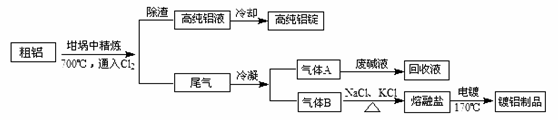
(注:NaCl熔点为801℃;AlCl3在181℃升华)
(1)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,相关的化学方程式为① 和②
(2)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮除去。气泡的主要成分除Cl2外还含有 ;固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在
(3)在用废碱液处理A的过程中,所发生反应的例子方程式为 、______________。
(4)钢材镀铝后能防止钢材腐蚀,其原因是
(5)铝与过量NaOH溶液反应的离子方程式为________________________。反应后溶液中通入过量CO2,所发生反应的离子方程式为__________________________。
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意图如下:
回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3+ + Fe ="===" 3Fe2+ 2TiO2+(无色)+ Fe + 4H+="===" 2Ti3+(紫色)+ Fe2++2 H2O
Ti3+(紫色)+ Fe3++ H2O ====TiO2+(无色)+ Fe2++2H+
加入铁屑的作用是 。
(2)在②→③工艺过程中需要控制条件以形成TiO2·nH2O溶胶,该溶胶的分散质颗粒直径大小在_________范围。
(3)写出④中TiO2和焦炭、氯气反应的化学方程式:______________________________。
(4)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是 (只要求写出一项 )。
(5)依据表格信息,要精制含少量SiCl 4杂质的TiCl 4,可采用 方法。
| TiCl4 |
SiCl4 |
|
| 熔点/℃ |
-25.0 |
-68.8 |
| 沸点/℃ |
136.4 |
57.6 |
磷、硫元素的单质和化合物应用广泛。
(1)磷元素的原子结构示意图_____________________。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500°C生成白磷,反应为:
2Ca3(PO4)2+6SiO2==6CaSiO3+P4O10 10C+P4O10==P4+10CO
每生成 1molP4时,就有 mol电子发生转移。
(3)硫代硫酸钠(Na2S2O2)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素完全氧化,剩余的I2用Na2S2O2溶液滴定,可测定溶液中维生素C的含量。发生的反应为:
C6H8O6+I2===C6H6O6+2H++2I- 2S2O32-+I2===S4O62-+2I-
在一定体积的某维生素C溶液中加入amolL-1I2溶液V1ml,充分反应后,用Na2S2O2溶液滴定剩余的I2,消耗bmolL-1 Na2S2O2溶液V2ml.该溶液中维生素C的物质量是 mol。
(4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生反应,生成物之一可以用淀粉溶液检验。根据反应溶液出现蓝色所需的时间来衡量该反应的速率,写出该反应的离子方程式为________________________。