有位于周期表前四周期的A、B、C、D、E、F六种元素,其原子序数依次增大。已知A原子核外有三个未成对电子;A与B形成的一种化合物常温下是红棕色气体;化合物C2E的晶体为离子晶体;D单质的熔点在同周期单质中最高;E原子核外的M层中只有两对成对电子;F原子核外最外层电子数与C相同,其余各层均充满。请根据以上信息,回答下列问题:
(1)A、B、C、D四种原子的第一电离能由小到大的顺序为______(用元素符号表示)。
(2)C的氯化物的熔点比D的氯化物的熔点 (填“高”或“低”),理由是 。
(3)E的最高价氧化物分子的空间构型是 。
(4)基态F+离子的核外电子排布式是 ,F的高价离子与A的最常见氢化物形成的配离子的化学式为 。
(5)Q分子是A2B的等电子体,Q的结构式为 ,Q分子的中心原子的杂化类型是 。
(6)下图是B、F两元素组成的一种化合物的晶胞,其化学式为 。
多昔芬主要用于防治骨质疏松等病症,其合成路线如下:
说明:D+G→H的转化中分别发生了加成反应和水解反应。
(1)D中含氧官能团的名称是。
(2)C→D的反应类型是,H→多昔芬的反应类型是。
(3)E→F转化中另一产物是HBr,则试剂X的结构简式是。
(4)H分子中有个手性碳原子。
(5)写出同时满足下列条件的A物质同分异构体的结构简式。
①能发生银镜反应;②与FeCl3发生显色反应;③苯环上的一溴代物只有2种。
(6)苯甲酰氯(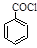 )是合成药品的重要中间体。请写出以苯、乙醚、甲醛为原料制备苯甲酰氯的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
)是合成药品的重要中间体。请写出以苯、乙醚、甲醛为原料制备苯甲酰氯的合成路线流程图(无机试剂任用)。合成路线流程图示例如下: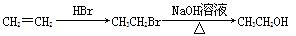
在5-氨基四唑( )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。
(1)基态Ga原子的电子排布式可表示为;
(2)5-氨基四唑中所含元素的电负性由大到小的顺序为,其中N原子的杂化类型为;在1 mol 5-氨基四唑中含有的σ键的数目为。
(3)叠氮酸钠(NaN3)是传统安全气囊中使用的气体发生剂。
①叠氮酸钠(NaN3)中含有叠氮酸根离子(N3-),根据等电子体原理N3-的空间构型为。
②以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物。其结构是用碳原子取代氮化钛晶胞(结构如图)顶点的氮原子,这种碳氮化钛化合物的化学式为。
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2(g)+CH4(g) 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
| 物质 |
CH4 |
CO2 |
CO |
H2 |
| 体积分数 |
0.1 |
0.1 |
0.4 |
0.4 |
①此温度下该反应的平衡常数K=。
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H="-890.3" kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H="2.8" kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H="-566.0" kJ·mol-1
反应CO2(g)+CH4(g) 2CO(g)+2H2(g) 的△H=。
2CO(g)+2H2(g) 的△H=。
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是。
②为了提高该反应中CH4的转化率,可以采取的措施是。
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为。
(3)以CO2为原料可以合成多种物质。
①聚碳酸酯是一种易降解的新型合成材料,它是由加聚而成。写出聚碳酸酯的结构简式:。
②以氢氧化钾水溶液作电解质进行电解,CO2在铜电极上可转化为甲烷,该电极反应方程式为。
莫沙朵林是一种镇痛药,它的合成路线如下:
(1)B中手性碳原子数为;化合物D中含氧官能团的名称为。
(2)C与新制氢氧化铜反应的化学方程式为。
(3)写出同时满足下列条件的E的一种同分异构体的结构简式:。
I.核磁共振氢谱有4个峰;
Ⅱ.能发生银镜反应和水解反应;
Ⅲ.能与FeCl3溶液发生显色反应。
(4)已知E+X→F为加成反应,化合物X的结构简式为。
(5)已知: 。化合物
。化合物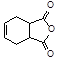 是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以
是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以 和
和 为原料合成该化合物(用合成路线流程图表示,并注明反应条件)。合成路线流程图示例如下:
为原料合成该化合物(用合成路线流程图表示,并注明反应条件)。合成路线流程图示例如下: 
实验室模拟回收某废旧含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)生产Ni2O3。其工艺流程为:


图Ⅰ图Ⅱ
(1)根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为。图Ⅱ表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是。
(2)工艺流程中“副产品”的化学式为。
(3)已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 |
Fe(OH)3 |
Fe(OH)2 |
Ni(OH)2 |
| 开始沉淀的pH |
1.5 |
6.5 |
7.7 |
| 沉淀完全的pH |
3.7 |
9.7 |
9.2 |
操作B是为了除去滤液中的铁元素,某同学设计了如下实验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。请对该实验方案进行评价:(若原方案正确,请说明理由;若原方案错误,请加以改正)。
(4)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3 mol·L-1,则Ca2+的浓度为mol·L-1。(常温时CaF2的溶度积常数为2.7×10-11)
(5)电解产生2NiOOH·H2O的原理分两步:①碱性条件下Cl-在阳极被氧化为ClO-;②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。第②步反应的离子方程式为。