为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如图所示的实验装置。
(1)气体发生装置A产生的气体是_____________。
(2)为验证通入D装置中的气体是Cl2过量还是SO2过量,某小组同学准备了以下试剂:①氯化铁溶液;②氯化亚铁溶液;③硫氰化钾溶液;④苯酚溶液;⑤品红溶液; ⑥酸性高锰酸钾溶液
Ⅰ.若Cl2过量:取适量D中溶液滴加至盛有__________(选填一个序号)的试管内,再加入____________(选填一个序号)试剂,实验现象是: 。
Ⅱ.若SO2过量:取适量D中溶液滴加至盛有____________(选填一个序号)的试管内,实验现象是:__________________________________。
(3)另一小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。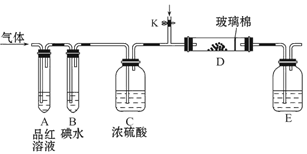
①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同?____________(填“相同”或“不相同”);
②若装置B中装有5.0 mL 1.0 mol·L-1碘水,当通入足量Cl2完全反应后,共转移了5.0×10-2 mol电子,该反应的化学方程式为 。
某气态烃A在标准状况下的密度为1.25g/L,其产量可以用来衡量一个国家的石油化工发展水平。B和D都是生活中常见的有机物,D能跟碳酸氢钠反应,F有香味。它们之间的转化关系如下图所示:


 (1)A的结构式为 ,B中官能团的电子式为 ,
(1)A的结构式为 ,B中官能团的电子式为 , D中官能团的名称为 。
D中官能团的名称为 。 (2)反应①的反应类型是 ,
(2)反应①的反应类型是 ,
反应③的化学方程式为 。
。

 (3)反应②在Cu做催化剂的条件下进行,该实验的步骤是将红亮的铜丝置于酒精灯上加热,待铜丝变为黑色时,迅速将其插入到装有B的试管中(如图所示)。重复操作2-3次,观察到的现象是 。该反应的化学方程式为 。
(3)反应②在Cu做催化剂的条件下进行,该实验的步骤是将红亮的铜丝置于酒精灯上加热,待铜丝变为黑色时,迅速将其插入到装有B的试管中(如图所示)。重复操作2-3次,观察到的现象是 。该反应的化学方程式为 。 (4)D与碳酸氢钠溶液反应的离子方程式为 。
(4)D与碳酸氢钠溶液反应的离子方程式为 。 (5)B、D在浓硫酸的作用下实现反应④,实验装置如下图所示:
(5)B、D在浓硫酸的作用下实现反应④,实验装置如下图所示:
 试管1中装药品的顺序为先取 (填“B”、“D”、“浓硫酸”,下同),再加入 ,最后加入 。图中X的化学式为 。
试管1中装药品的顺序为先取 (填“B”、“D”、“浓硫酸”,下同),再加入 ,最后加入 。图中X的化学式为 。 浓硫酸的作用是 。
浓硫酸的作用是 。 该反应的化学方程式为 。
该反应的化学方程式为 。
二乙酸—1,4—环己二醇酯可通过下列路线合成:
(1)上述合成过程中没有涉及的反应类型是 ▲
| A.加成 | B.消去 | C.取代 | D.氧化E.聚合 F.酯化 |
(2)与 互为同分异构体,满足条件:①能发生银镜反应和酯化反应;②
互为同分异构体,满足条件:①能发生银镜反应和酯化反应;②
所有碳原子在一条直链上的同分异构体有 ▲种。
(3)写出②的反应方程式 ▲;
写出⑤的反应方程式 ▲。
(4)请设计合理的方案以CH2=CH—CH=CH2(1,3—丁二烯)和醋酸为原料合成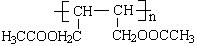 (用合成路线流程图表示,并注明反应条件)。
(用合成路线流程图表示,并注明反应条件)。
提示:①合成过程中无机试剂任选; ②合成路线流程图示例如下:
CH3CH2OH  H2C=CH2
H2C=CH2
▲
某有机物A,由C、H、O三种元素组成,在一定条件下,A、B、C、D、E、F具有下列转化关系:
已知D的蒸气密度是氢气的29倍,并可以发生银镜反应。
(1)写出F的结构简式 ▲;
(2)写出C → A的反应条件 ▲;
(3)写出A → D的反应方程式 ▲。
写出B → C的反应方程式 ▲。
根据要求回答下列问题。
(1)分子球棍模型可以帮助人们认识有机物的结构。
下列是某有机物的分子比例模型,其中不同颜色的球代表不同的原子,球之间的“棍”
表示单键、双键或三键。
该有机物分子中可能存在的两种官能团的名称分别为 ▲、 ▲;
这类有机物在化学性质上表现的特点是 ▲。
(2)有机物的特征性质常可用以有机物之间的鉴别。
①欲区分葡萄糖和淀粉,可选用 ▲(填字母)。
A.碘水 B.银氨溶液 C.盐酸 D.NaOH溶液
②欲区分 和
和 ,可选用 ▲(填字母)。
,可选用 ▲(填字母)。
A.AgNO3溶液 B.NaOH溶液 C.FeCl3溶液 D.Na2CO3溶液
(3)同分异构现象是有机物种类繁多的原因之一。
分子式为C7H6O2的有机物有多种同分异构体,其中含有苯环和1个侧链的同分异构体的结构简式是 ▲、 ▲……。
(4)高分子化合物在生产、生活中有着广泛的应用。
PES(聚丁二酸乙二醇酯)是一种生物可降解的聚酯,它在塑料薄膜,食品包装等方面有着广泛的应用。其结构简式如下:
合成PES的有机化学反应类型是 ▲反应。形成该聚合物的两种单体的结构简式分别是 ▲和 ▲。
某化学兴趣小组的同学对实验室乙酸乙酯的制取和分离进行了实验探究。
制备:下列是该小组同学设计的实验装置。回答下列问题: 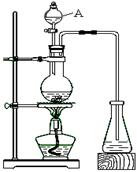
(1)仪器A的名称▲,装置中长导管的主要作用是▲;
(2)证明锥形瓶中收集到乙酸乙酯的简单方法是 ▲;
分离:锥形瓶中得到的产物是混合物,为了分离该混合物,设计了如下流程: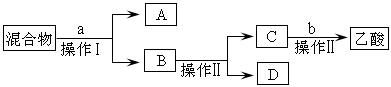
(3)a试剂最好选用 ▲;
(4)操作Ⅰ、操作Ⅱ分别是 ▲
| A.过滤、分液 | B.萃取、蒸馏 | C.分液、蒸馏 | D.过滤、蒸发 |
讨论:研究表明质子酸离子液体也可用作酯化反应的催化剂。通过对比实验可以研究不同催化剂的催化效率,实验中除了需控制反应物乙酸、乙醇的用量相同外,还需控制的实验条件是 ▲。